Nature Methods:从数据洪流到精准测绘!ACE重新定义全脑神经元分析 |
 |

揭开大脑的神秘面纱:为什么神经元活动的精准测绘如此重要?
大脑是已知最复杂的信息处理系统,拥有约860亿个神经元(neurons),每个神经元可以与数千个其他神经元相连接,形成一个由数百万亿突触(synapses)构成的庞大网络。这种网络不仅支持感知、运动和记忆的基本功能,还塑造了个体的情绪、决策和创造力。
要理解大脑的工作方式,研究人员需要追踪神经元在不同状态下的活动模式,比如当个体处于压力状态、学习新技能或经历情绪波动时,不同脑区的神经元群体如何协同工作。然而,面对如此复杂的系统,仅仅研究单个神经元或局部脑区的活动显然是不够的,研究人员需要一种可以在整个大脑范围内,以高分辨率解析神经元活动的方法。
光片荧光显微镜(light-sheet fluorescence microscopy, LSFM)技术的出现为全脑成像带来了革命性的进展,它可以一次性采集完整大脑的三维图像,提供单细胞(cellular-resolution)级别的结构和功能数据。但与此同时,LSFM数据的规模也极为庞大,一个实验产生的数据可达数万亿体素(teravoxel scale),远超传统图像处理方法的承载能力。如何在这样的超大规模数据中,准确定位并解析神经元活动,成为神经科学研究的一大挑战。
神经元活动与认知行为:解码大脑的运行机制
大脑的运作依赖于神经元的精确放电(firing)和神经网络的协同活动。例如,当我们伸手触碰物体时,感觉皮层(somatosensory cortex)的神经元会瞬间活跃,将触觉信号传递到大脑的相关区域进行处理;当我们面对复杂决策时,前额叶皮层(prefrontal cortex)的神经元会动态调整其连接模式,权衡不同选项的利弊。这些过程都是在庞大的神经网络中实时发生的,而传统的研究方法往往难以捕捉这些瞬时且局部的变化。
传统研究方法的局限性:为什么我们需要新的工具?
尽管神经科学家已经开发了许多研究神经元活动的方法,但传统的方法仍然存在许多局限性,使得研究人员无法全面解析大脑的神经活动模式。
依赖脑图谱,难以精准解析个体差异:目前,很多神经科学研究依赖于标准脑图谱(brain atlas),例如Allen Mouse Brain Reference Atlas(ARA),来定义大脑不同区域的神经活动。然而,脑图谱是基于多个样本的平均数据构建的,它无法准确反映个体之间的微观差异。
传统方法依赖人工干预,分析效率低下:以往的神经元检测方法,如Ilastik或Cellfinder,通常依赖于手动参数调整或专家标注,这种方法既耗时又容易受主观偏见的影响。
统计分析受限,难以发现隐藏的局部变化:在全脑数据的分析中,研究人员通常使用体素(voxel)统计或ROI分析方法。然而,这些方法要么对单个体素进行独立统计,要么在一个大脑区域内进行平均计算,导致许多局部的重要神经活动模式被忽略。
从显微镜到大数据:如何观察整个大脑的神经元活动?
大脑的复杂性使得研究人员不仅要观察单个神经元的活动,还必须理解它们在整个大脑中的分布和相互作用。要做到这一点,研究人员需要既能覆盖全脑范围,又能提供单细胞分辨率的成像技术。光片荧光显微镜(light-sheet fluorescence microscopy, LSFM)的出现,使得全脑神经元成像成为可能,但与此同时,也带来了数据分析上的巨大挑战。
光片荧光显微镜(LSFM):解锁全脑神经元活动的关键技术
传统的神经科学研究依赖于薄片切片和二维显微镜成像,虽然可以提供细胞级别的信息,但往往难以保持三维组织结构的完整性。LSFM是一种革命性的成像技术,它能够对整个大脑进行快速成像,并提供单细胞分辨率,从而让研究人员能够在完整的三维环境中研究神经元活动。
LSFM的核心优势:
大视野高分辨率:能够以单细胞(cellular-resolution)级别获取完整的三维脑组织数据,避免了传统显微镜因样本切片导致的信息丢失。
成像速度快:相比共聚焦显微镜,LSFM使用片状激光照明样本,能在短时间内完成整个大脑的成像,大幅提高了数据采集效率。
适用于透明化样本:结合组织透明化技术(如CLARITY、iDISCO等),LSFM能够在不破坏组织结构的情况下,直接对整个大脑进行成像,保留神经元网络的完整性。
该研究使用LSFM对18只Tg TRAP2-Ai9转基因小鼠进行全脑成像,并重点关注c-Fos标记的神经元活性。研究人员采集了大量三维(3D)影像数据,并将其划分为每个体素大小约0.35 mm 的子图像(patches),以便进行后续分析。然而,这些数据的体量之大,远远超出了传统数据分析工具的承载能力。
数据挑战:从TB级到PB级,如何解析超大规模神经元数据?
LSFM虽然解决了全脑成像的问题,但它带来的海量数据也成为了神经科学研究的一大障碍。一个完整的大脑成像数据可达到数万亿体素(teravoxel scale),其数据量可达TB级甚至PB级,远远超过传统计算机视觉方法的处理能力。
研究人员在该研究中面对的核心数据挑战包括:
数据规模过大,传统分析方法难以处理
以往的显微镜数据通常在GB级别,但LSFM产生的数据量是其数百甚至上千倍。
例如,ACE pipeline在训练过程中使用了15,200个3D图像patches,总数据量远超普通机器学习任务,导致传统方法(如手动标注和传统图像分割算法)根本无法有效应对。
神经元形态多样,单纯依赖传统算法难以泛化
不同脑区的神经元在形态、密度和信号强度上存在巨大差异,传统基于阈值或形态学特征的分割方法(如Ilastik、Cellfinder)在不同实验条件下泛化能力较差。
研究团队发现,在低信号或模糊区域,这些传统方法容易出现高误检率(false positives)或遗漏神经元(false negatives),从而影响研究结论的可靠性。
分析方法必须适应不同实验室、不同扫描参数的数据
由于LSFM数据的获取方式可能因实验室、显微镜参数和样本处理方法的不同而有所变化,导致数据之间的信号噪声比(SNR)、对比度(contrast)和光学畸变(optical artifacts)存在显著差异。
研究人员发现,传统方法在训练数据上表现良好,但在未见过的数据(unseen datasets)上,性能大幅下降,难以满足科学研究的需求。
ACE(Artificial Intelligence-based Cartography of Ensembles):突破神经科学测绘的AI新工具
为了解决上述问题,研究团队开发了一种基于人工智能(AI)的神经元绘图方法 ACE(Artificial intelligence-based Cartography of Ensembles)。这一端到端(end-to-end)的深度学习(deep learning, DL)pipeline,专为LSFM数据而设计,能够精准、高效、自动化地检测和分析全脑神经元活动。
ACE的核心创新点:
端到端的深度学习pipeline 无需手动调整参数,即可全自动完成神经元检测和分割。
结合两种先进的AI架构,提升神经元识别精准度:视觉变换器(Vision Transformer, ViT) 能有效解析神经元在复杂三维空间中的分布模式。
三维U-Net(3D U-Net) 专为医学和生物影像处理优化,精准分割神经元。
采用不确定性评估(Uncertainty Estimation),确保检测的可靠性。
超强泛化能力 ACE经过不同实验环境和数据集的严格测试,适用于多种成像和实验条件。
ACE的核心原理:AI如何精准识别神经元?
深度学习驱动的端到端pipeline
在传统神经元分析方法中,研究人员通常需要进行多个步骤的手动干预,比如图像预处理、阈值设定、手动调整参数等。这不仅耗时,还容易引入人为误差。ACE采用端到端深度学习方法,完全摆脱了手动调整参数的需求,它能够直接从LSFM数据输入,自动完成神经元分割、特征提取、统计分析等多个步骤,大幅提高效率和准确性。
ViT+3D U-Net双引擎,提升分割精准度
ACE的核心在于结合两种先进的AI架构,最大程度提高神经元识别的精准度。
视觉变换器(Vision Transformer, ViT)ViT最初用于自然图像分析,现在被用于三维神经元检测。它通过自注意力机制(self-attention),能够在大范围内建立神经元之间的空间关系,有效捕捉神经元在复杂三维结构中的层级分布。
三维U-Net(3D U-Net)传统的U-Net在二维显微镜数据上表现优异,而ACE采用的是专门针对三维数据优化的3D U-Net。
3D U-Net能够学习神经元的空间结构,对形态复杂、信号微弱的神经元进行精准分割。
在ACE的架构中,ViT和3D U-Net相互配合,ViT捕捉全局特征,3D U-Net进行局部精细化分割,最终生成高精度的神经元检测结果。
实验数据显示,ACE的Dice相似性系数(DSC)比传统方法提高0.17,在不同数据集上的泛化能力远远超过现有的分析工具。
不确定性评估:AI如何自我检测准确性?
一个重要的问题是:AI如何知道自己识别的神经元是否准确?ACE通过不确定性评估(uncertainty estimation)解决了这个问题。
研究人员使用蒙特卡洛Dropout(Monte Carlo Dropout)技术,让ACE在同一张图像上进行多次预测,并计算不同预测之间的方差。
结果表明,当ACE对某些神经元的识别存在不确定性时,该区域往往也是人类专家难以分辨的区域,比如神经元边界模糊或信号强度较低的地方。
研究团队利用这一点来优化ACE的表现,确保最终的神经元检测结果更具可信度。
实验表明,相比传统方法,ACE在低信号或模糊区域的神经元识别准确率更高,误检率更低。
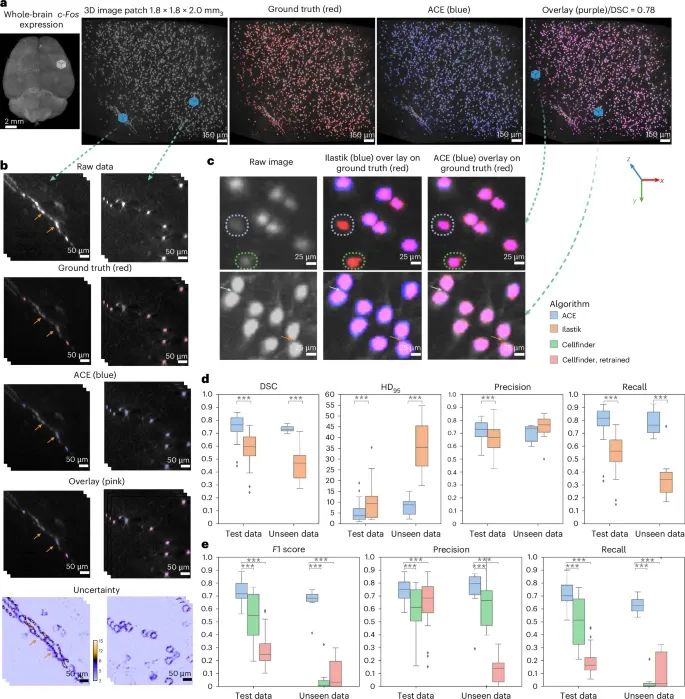
ACE(Artificial intelligence-based Cartography of Ensembles)在全脑范围内神经元胞体分割任务中的性能表现(Credit:Nature Methods)
(a) 全脑c-Fos表达的最大强度投影渲染图
图中展示了全脑范围内c-Fos表达的三维图像,并放大显示了一个皮层局部区域(cortical patch)。在放大的子区域中,显示了通过ACE的视觉变换器(ViT)集成模型预测的分割图(蓝色),与人工标注的真实值(GT,红色)对比。结果表明,ACE能够准确捕捉神经元胞体的位置和形态,但某些区域的边界存在轻微误差。
(b) 原始图像与不确定性分析
两个图像patch被用来展示ACE的性能:左列:含有稀疏错误标注的神经元突触(如轴突)。右列:含有神经元胞体的区域。图中显示了原始图像、真实值(GT)和分割图,并结合体素级不确定性图(uncertainty maps)进行分析:不确定性较高的区域集中在边界处,尤其是稀疏错误标注的突触和神经元胞体的边缘。箭头指出了误分割的区域,进一步揭示了ACE在复杂区域的表现特点。
(c) 定性评估:ACE与Ilastik的对比
在处理低信号强度或轻微模糊的神经元分割任务中,ACE的表现明显优于Ilastik:上部对比:ACE更准确地检测到低信号强度或模糊的神经元。下部对比:在接近的两个神经元之间,ACE更清晰地划分了其边界(由箭头标注)。总体上,ACE在信号较弱或形态复杂的神经元检测上,优于传统的Ilastik方法。
(d,e) 定量评估:ACE与Ilastik和Cellfinder的性能对比
(d):ACE与Ilastik在分割精度(segmentation accuracy)方面的对比:
使用测试数据集(n=12,160个patch)和未见过的数据集(n=1,824个patch)进行评估,考察了平均DSC(Dice相似性系数)、精准度(Precision)、召回率(Recall)、HD95(Hausdorff距离95%)和F1得分。ACE在所有指标上的表现均显著优于Ilastik,特别是在DSC和F1得分上。Box plot显示:ACE在所有测试中具有更高的中位数和更小的分布范围,表明其结果更加稳定可靠。
(e):ACE与Cellfinder在检测精度(detection accuracy)上的对比:
ACE在所有评估指标上均优于Cellfinder,尤其在低信号或未见过的数据中,ACE表现出更强的检测能力。统计分析(Mann Whitney U检验)显示,ACE的表现显著优于对照方法(P 0.0001)。
ACE如何揭示神经元活动的新模式?
人工智能在神经科学领域的应用能否真正推动科学进展,最终还要看它在实际研究中的表现。为验证ACE(Artificial intelligence-based Cartography of Ensembles)的实用性,研究团队将其应用于两项具体实验:冷诱导食物觅食和行走与神经元活动。结果显示,ACE不仅能够检测到传统方法遗漏的隐藏神经元活动模式,还揭示了潜在的神经机制,为理解大脑功能提供了全新视角。
冷诱导食物觅食(Cold-induced Food Seeking)
寒冷环境对动物行为和能量代谢的影响,是神经科学领域的一个重要研究方向。当动物暴露于低温环境中时,大脑特定区域的神经元会被激活,从而调控觅食行为。研究团队利用ACE分析了18只小鼠的全脑LSFM数据,其中4只暴露于4 C的冷环境(实验组),另4只暴露于30 C的对照环境(对照组)。目标是揭示哪些脑区的神经元活动在低温环境中显著增强。
以往的ROI分析方法主要依赖脑图谱进行数据比对。虽然可以检测到一些常规活跃脑区(如丘脑的部分区域),但对隐藏的神经元活动模式难以察觉,尤其是那些分布在未定义脑图谱区域的小型亚区。此外,传统方法通常需要依赖研究者的先验假设,难以做到全脑范围内的无偏分析。
通过ACE的无偏分析,研究团队在4 C实验组中发现了一个关键区域的神经元活动显著增强 丘脑背中线区域(midline thalamic nuclei, MTN)。进一步的统计分析揭示了剑突核(xiphoid nucleus, Xi)这一亚区在寒冷环境下的潜在作用:
剑突核的特征:Xi是一个位于丘脑中线的小型亚区,未被传统脑图谱单独划分。
神经元活动增强:在4 C环境下,Xi的c-Fos表达水平显著高于30 C对照组,表明其神经元在寒冷诱导的觅食行为中可能扮演了重要角色。
研究人员利用ACE的集群增强统计(threshold-free cluster enhancement, TFCE)进一步验证了Xi的活跃模式。结果显示,Xi的神经元活动显著关联于觅食行为的启动,这一发现为寒冷环境如何调控能量代谢提供了全新视角。
ACE无需预定义脑图谱区域,能够自动检测隐藏的神经元活动模式,避免了传统ROI分析的偏倚。通过发现Xi的活动模式,ACE为研究寒冷诱导的觅食行为提供了更细致的脑区解析。
行走与神经元活动(Walking-induced Activation)
行走是一种复杂的运动行为,涉及多个脑区和神经网络的协调活动。为了研究与运动相关的神经元活动模式,研究团队设计了一项对比实验:分析3只在正常活动笼中保持静止的对照小鼠(对照组),以及3只自由行走的小鼠(实验组)。通过ACE分析两组小鼠的全脑LSFM数据,研究团队试图揭示行走过程中活跃的特定脑区和神经元层级。
以往的研究多集中于脑图谱中标注的大脑运动区域,通常忽略了神经元在不同皮层层级(layers)的分布和作用。此外,传统方法对低信号区域的识别能力有限,可能遗漏与运动密切相关的小型脑区或亚区的活动模式。
通过ACE的高分辨率分析,研究团队在行走组中发现了多个与运动相关的活跃脑区,并揭示了传统方法未能探测的神经元活动模式:
初级运动皮层(MOp)的层级激活
ACE检测到MOp中特定的Layer 6a在行走过程中显著激活,而这一层级通常被传统ROI方法忽略。
研究人员进一步发现,Layer 6a可能与丘脑-皮层投射(thalamocortical projections)密切相关,这种投射在运动控制中起关键作用。
外侧下丘脑区(LHA)的局部激活
ACE在LHA的特定亚区检测到显著的神经元活动增强。
LHA的这一局部活跃模式可能与运动行为中的能量调控有关。更重要的是,这一发现提示LHA可能在运动恢复和康复过程中发挥作用,为运动神经康复研究提供了新的切入点。
ACE能够检测到运动相关脑区的特定层级(如MOp的Layer 6a),这一能力是传统方法无法实现的。LHA的局部激活模式提供了运动调控的新视角,这在ROI分析中往往会被忽略。
人工智能如何赋能神经科学?
随着ACE(Artificial intelligence-based Cartography of Ensembles)的开发和应用,人工智能在神经科学领域展现了前所未有的潜力。通过在超大规模神经数据中精准检测和分析神经元活动,ACE不仅解决了传统方法的技术瓶颈,还为神经科学的未来发展提供了更多可能性。未来,ACE有望在脑功能解析、神经疾病研究、脑机接口技术以及多模态成像整合等多个领域带来深远影响。
解码更多脑功能:揭示未知的神经活动模式
大脑是一个高度复杂的系统,涉及多种功能的精密协作。从学习和记忆,到情绪调控和决策能力,大脑的每一项功能都与特定的神经元活动模式密切相关。然而,由于传统神经科学技术的限制,许多复杂脑功能的神经机制仍然处于未知状态。
ACE的潜力
全脑范围内的精细解析:通过ACE的深度学习pipeline,研究人员能够对整个大脑的神经元活动进行无偏分析,不再局限于传统的脑区划分。这为解码大脑在学习、记忆、情绪调控等复杂功能中的活动模式提供了强有力的工具。
跨个体差异的解析能力:ACE在个体之间的脑功能差异研究中具有优势。通过在不同实验组和个体上的广泛适应性,ACE可以揭示个体化的神经活动模式,为个性化神经科学研究提供数据支持。
在学习与记忆研究中,ACE可以帮助追踪海马体(hippocampus)等关键区域的动态活动模式,揭示记忆的编码、存储和提取过程。
在情绪研究中,ACE或将揭示与情绪生成和调控相关的深层脑区(如杏仁核(amygdala)和前额叶皮层)的活动规律,推动情感计算领域的发展。
应用于神经疾病研究:为精准医疗提供支持
神经退行性疾病(如、)和精神类疾病(如、焦虑症)常常涉及局部神经元活动的异常。然而,这些异常活动模式通常难以通过传统的影像学或脑图谱分析检测到,尤其是在疾病早期。
ACE的贡献
早期检测:通过全脑范围的精细神经元检测,ACE能够发现传统方法无法识别的局部异常活动。例如,在帕金森病模型中,ACE或许能够揭示黑质(substantia nigra)和基底节回路(basal ganglia circuits)的早期神经元活动变化。
疾病进程的动态监测:ACE可以连续分析神经元活动的时空动态,为研究神经疾病的进展机制提供高分辨率数据。
药物干预效果评估:ACE还可以用于评估药物对神经元活动模式的调控效果。例如,在阿尔茨海默病模型中,ACE或能检测出药物是否改善了海马体CA1区的神经元活动,为精准治疗提供依据。
推动脑机接口(BCI)发展:打造更精准的人机交互系统
脑机接口(brain-computer interface, BCI)是连接大脑与外部设备的一种前沿技术,其关键在于精准解码神经元的活动信号。现有的BCI技术主要依赖电极记录大脑活动,但受限于记录精度和数据解析能力。
ACE的前景
提供高分辨率数据支持:通过ACE的神经元活动图谱,研究人员能够更准确地定位与特定运动或认知功能相关的神经元活动群体,为BCI信号解码提供基础。
优化脑机交互算法:ACE的深度学习技术可以直接应用于BCI的算法设计,提升大脑信号解码的精度和实时性。
个性化BCI开发:ACE具备跨个体适应能力,能够为每个用户定制专属的BCI解码模型,从而实现更精确的人机交互。
应用场景
在运动康复领域,ACE结合BCI技术可以帮助中风或脊髓损伤患者通过神经活动控制外骨骼设备,恢复运动能力。
在神经调控领域,ACE可用于开发基于神经元活动反馈的自适应脑机接口,改善癫痫或其他神经患者的。
向更高维度进化:整合多模态成像与空间转录组技术
尽管ACE已经在光片荧光显微镜(LSFM)数据中展现了卓越的能力,但未来的发展方向将超越单一成像模式,向多模态数据整合迈进。
结合多光子成像(Multiphoton Imaging)多光子显微镜可以提供更高的时间分辨率,捕捉神经元的动态活动。将ACE与多光子成像数据结合,可以让研究人员实时观察神经元网络的激活模式和连接变化。
整合空间转录组学(Spatial Transcriptomics)空间转录组学技术能够同时提供基因表达和空间信息。ACE未来可以与空间转录组数据整合,从而在功能活动和基因表达层面实现双重解析:通过将神经元的活动模式与其基因表达特征相关联,揭示特定基因如何调控神经元的功能。在疾病研究中,ACE可以帮助研究神经元活动异常与特定基因表达的关系,为治疗提供线索。
实现更精细的大脑功能解析未来,ACE还可以与其他前沿技术(如钙成像、光遗传学)整合,进一步提升解析能力。例如,通过结合钙成像,ACE可实时捕捉神经元群体的动态放电模式,并与结构数据叠加,从多个维度描绘神经元的功能特性。
从揭示未知的脑功能,到精准检测神经疾病,再到推动脑机接口和多模态整合,ACE正引领神经科学迈向一个更精细、更智能的新时代。它不仅为科学研究提供了前所未有的工具,也为神经科学的应用化发展铺平了道路。
未来,随着技术的不断进步,ACE有望成为解析大脑奥秘的核心工具,在科学、医疗和技术领域产生深远影响。神经科学的下一个黄金时代,正因人工智能的赋能而加速到来。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 传奇科学家乔治·丘奇的抗衰老论文被撤稿!论文作者曾亲自“当小白鼠”,宣称年轻20岁 (2025-09-09)
- 《中药临盆监视治理专门规则》宣布 来岁3月1日起实施 (2025-09-09)
- 国度药监局对于宣布中药临盆监视治理专门规则的布告 (2025-09-09)
- Science:“毒”空气与痴呆的隐秘共谋——当PM2.5化身神经退行性疾病的“催化剂” (2025-09-09)
- 《细胞》子刊:芝加哥大学团队首次发现,玉米黄素竟能增强CD8阳性T细胞抗癌能力! (2025-09-09)
- 军事医学科学院×国防科技大学合作Cell子刊论文:AI从头设计广谱抗菌肽,同时对抗细菌和真菌 (2025-09-09)
- 为什么压力会让血糖升高?Nature研究揪出“幕后推手”:大脑杏仁核通过“神经专线”操控肝脏,2 型糖尿病风险与情绪脑有关 (2025-09-09)
- Cell:从110万年前猛犸象化石中发现最古老的宿主相关细菌DNA (2025-09-09)
- 业内子士山西太原聚焦生物医药行业牌号品牌维护 (2025-09-08)
- Nature:Cas9的“B面人生”——从基因剪刀到免疫记忆的调速器 (2025-09-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















