Cell重磅:AI从头设计微型蛋白调控钠通道,逆转心律失常和癫痫 |
 |
来源:生物世界 2025-08-23 17:01
该研究首次通过人工智能(AI)从头设计出特异性靶向 NaV1.5 的微型调控蛋白——ELIXIR,可精准修复钠离子通道功能障碍,逆转相关心律失常和癫痫。离子通道是细胞膜上的一类特殊蛋白质,负责调控离子的跨膜流动,在维持细胞电生理活动和信号转导中起关键作用,例如电压门控钠离子通道(NaV),通过快速介导钠离子(Na+)内流触发电信号传导,是调控可兴奋细胞(例如神经元、心肌、骨骼肌细胞)动作电位的关键,其功能异常会导致持续性钠电流(INaL)增强,这是导致、癫痫、肌强直、和智力障碍等多种严重疾病的共同分子机制。
能够调控离子通道功能的策略备受期待,然而,包括小分子药物学在内的现有方法存在局限性,且常常会产生脱靶效应。在自然界中,离子通道的功能通过进化而来的调节蛋白进行定制,以满足不同的生理需求。过去几十年的结构生物学研究为离子通道-调控蛋白的相互作用提供了前所未有的原子级视角,并揭示了调控机制。然而,从头设计或合成具有高度特异性的离子通道调控蛋白,一直未能实现。
在自然界中,离子通道的功能可塑性是这些蛋白质的一个显著特征,这通常通过与多种辅助亚基或调控蛋白的结合来实现,这些辅助亚基或调控蛋白经过漫长的进化以微调特定通道的特性。过去几十年的结构生物学研究为离子通道-调控蛋白的相互作用提供了前所未有的原子级视角,并揭示了调控机制。然而,从头设计或合成具有高度特异性的离子通道调控蛋白,一直未能实现。
2025 年 8 月 18 日,哥伦比亚大学的研究人员在国际顶尖学术期刊Cell上发表了题为:De novodesign of a peptide modulator to reverse sodium channel dysfunction linked to cardiac arrhythmias and epilepsy的研究论文。
该研究首次通过人工智能(AI)从头设计出特异性靶向NaV1.5的微型调控蛋白 ELIXIR,可精准修复钠离子通道,逆转相关心律失常和癫痫。
 离子通道的活动是动态且受到严格调控的,这使得细胞能够调整自身的电学特性以适应生命活动的复杂需求。对于电压门控离子通道而言,其功能的病理生理变化会导致通道动力学发生改变,从而扰乱整体的电生理信号传导。例如电压门控钠离子通道(NaV),是人体电信号的 启动开关 ,其快速开闭特性控制着心肌收缩与神经元放电。当基因突变(例如SCN5A、SCN8A 基因突变)或病理损伤(例如、缺血)破坏通道的 自动关闭 机制时,会导致持续性钠电流(INaL)异常增大,从而诱发心律失常,以及神经元过度兴奋引发的癫痫。
离子通道的活动是动态且受到严格调控的,这使得细胞能够调整自身的电学特性以适应生命活动的复杂需求。对于电压门控离子通道而言,其功能的病理生理变化会导致通道动力学发生改变,从而扰乱整体的电生理信号传导。例如电压门控钠离子通道(NaV),是人体电信号的 启动开关 ,其快速开闭特性控制着心肌收缩与神经元放电。当基因突变(例如SCN5A、SCN8A 基因突变)或病理损伤(例如、缺血)破坏通道的 自动关闭 机制时,会导致持续性钠电流(INaL)异常增大,从而诱发心律失常,以及神经元过度兴奋引发的癫痫。
传统药物,例如雷诺嗪,能够抑制心肌细胞的INaL,用于治疗和心率异常,但会误伤正常钠电流,且对部分突变通道无效。
那么,我们可否利用蛋白质从头设计,针对性设计一种 智能补丁 ,来修复发生故障的离子通道?
在这项最新研究中,研究团队基于电压门控钠离子通道(Naᵥ)的蛋白结构,利用蛋白质计算设计平台 AfDesign,模拟了数百万种不同的多肽构型,最终 幻想 出仅由 21 个氨基酸组成的多肽链 ELIXIR(engineered late-current inhibitor X by inactivation-gate release)。
ELIXIR能够竞争性结合到Naᵥ1.5的羧基末端结构域(CTD),从而释放被 卡住 的失活门(IG),促使通道正常关闭。进一步实验验证显示,ELIXIR 的结合强度达亚微摩尔级,且仅靶向病理状态下的INaL。
研究团队进一步验证了ELIXIR 对心脏和大脑的实际保护效果,结果显示,在细胞层面,ELIXIR 使突变通道( KPQ、F1759A等)的INaL降低 3-12 倍,在心力衰竭小鼠中,ELIXIR 稳定了心律,并成功逆转了长 QT 综合征的心脏细胞的异常电信号。在癫痫模型神经元中,ELIXIR 恢复了动作电位时程,显著降低了癫痫神经元的 去极化阻滞 ,抑制了过度兴奋。
该研究的亮点:
从头设计的多肽 ELIXIR 可逆转钠通道的获得性功能缺陷;
ELIXIR 表现出选择性靶向 致病性 的持续性钠电流;
在癫痫相关 SCN8A 模型的神经元中,ELIXIR 减少了去极化阻滞;
ELIXIR 在多种疾病模型中缩短了心脏动作电位时程。
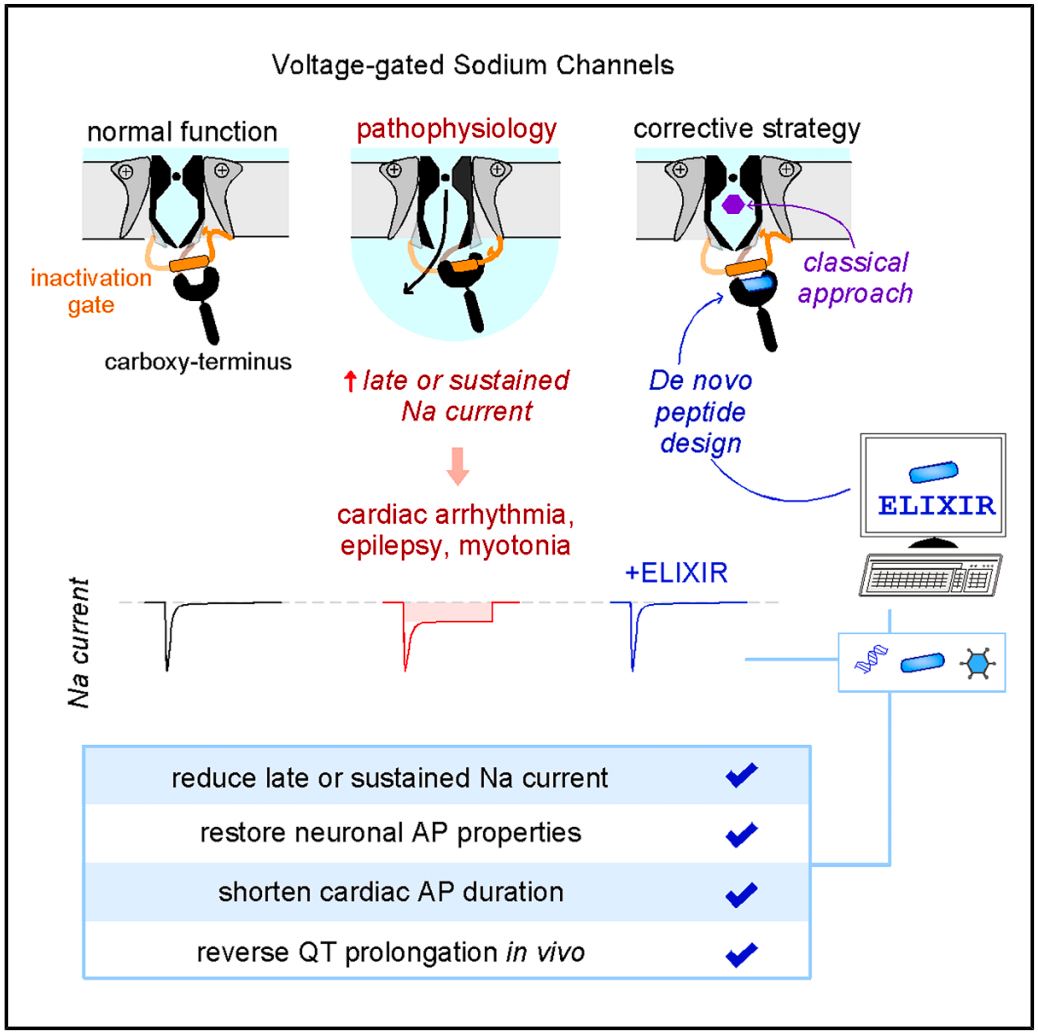
总的来说,这项研究证明了从头设计蛋白质在合成离子通道调控蛋白方面的有效性,首次利用 AI 从头设计的微型蛋白重置了心脏和大脑的电信号开关,这为通过蛋白质从头设计来治疗离子通道异常引起的心律失常、癫痫、慢性疼痛等多种疾病奠定了基础。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 《细胞·代谢》:华科大团队发现,慢性压力扰乱“肝-脑代谢轴”,促进小鼠的抑郁样行为! (2025-10-03)
- Science:生存的两种“投资学”——伪装是机会主义套利,警戒色是长期价值投资? (2025-10-03)
- Nature子刊:赵蔚团队发现,靶向相分离,治疗胶质母细胞瘤 (2025-10-03)
- 5年生存率不足10%,“癌王”难治的原因找到了!《自然》子刊发现它们有特殊入侵方式 (2025-10-02)
- Science:迄今最大规模人类蛋白互作图谱发布!系统鉴定了17849组高置信度蛋白互作,其中3631组为全新首次发现 (2025-10-02)
- Nat Neurosci: 激素调控月经周期中的全脑结构动态 (2025-10-02)
- Adv Sci:空军军医大学黄静等人研究阐明ACC依赖机制连接牙颌结构异常与慢性疼痛-情绪共病 (2025-10-02)
- 长寿可以遗传?《科学》研究发现某些优势或能传到第四代 (2025-10-02)
- Nat Commun:南方医科大学张先荣研究发现巨噬细胞双调蛋白诱导脓肿附近脂肪前体细胞肌成纤维细胞转变 (2025-10-02)
- Nature:新研究鉴定出蛋白LRP8是蜱传脑炎病毒入侵人类脑细胞的受体 (2025-10-02)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















