BCRT:揭示铁死亡在抵御人类乳腺癌药物耐受性上所扮演的关键角色 |
 |
来源:100医药网 2024-09-21 09:35
本文研究结果表明,揭示能克服药物耐受性的活性和细胞死亡通路的改变,或许能帮助确定可能能最好地预防或逆转对FOXM1治疗靶向性耐药的手段,从而就有望最终改善癌症患者的临床治疗结局。由于会产生获得性耐药性,因此癌症疗法常常会变得无效。近日,一篇发表在国际杂志Breast Cancer Research and Treatment上题为 Resistance to FOXM1 inhibitors in breast cancer is accompanied by impeding ferroptosis and apoptotic cell death 的研究报告中,来自伊利诺伊大学等机构的科学家们通过研究发现了一种治疗药物耐受性的潜在新型疗法,文章中,研究者揭示了铁死亡(ferroptosis)在克服癌细胞对FOXM1抑制剂获得性耐药性中所扮演的重要角色。
耐药性能通过降低许多长期疗法的疗效,从而给很多乳腺癌患者带来了一大治疗难题,尽管一种特定的疗法能杀死大多数癌细胞,但仍然有很小一部分比例的癌细胞对疗法会产生一定的耐药性,并能使其存活、生长和扩散。癌细胞的生存和生长的能力依赖于细胞增殖和细胞死亡之间的平衡,控制乳腺癌细胞增殖、生长和生存的量大主要的调节性因子包括雌激素受体(estrogen receptor)和FOXM1,FOXM1是一种在很多癌症中都会高表达的促癌转录因子,其在大多数正常成年人组织中并不存在,FOXM1能刺激细胞增殖,但正如研究者所说,其也能抑制细胞死亡,从而促进肿瘤的存活。
研究者Benita Katzenellenbogen教授说道,如果你拥有更多的细胞,其死亡或许就不那么好了,机体的肿瘤就会变得更大且更具侵袭性;这项研究中,我们想通过研究描述FOXM1在促进乳腺癌细胞存活和侵袭性方面的作用,旨在改善乳腺癌患者的临床治疗结局。首先研究人员开发了一种称之为NB化合物的FOXM1抑制剂,其能结合FOXM1并阻断其活性,但最初会被NB化合物所抑制的一些乳腺癌细胞则会对其杀伤作用产生耐受性,从而导致这些癌变细胞的生存和生长。
揭示铁死亡在抵御人类乳腺癌药物耐受性上所扮演的关键角色
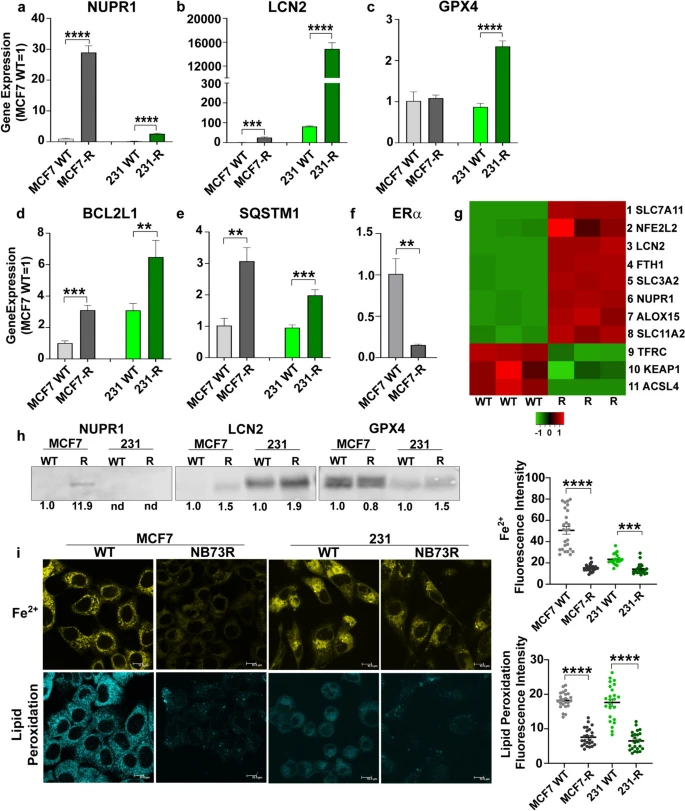
图片来源:Breast Cancer Res Treat (2024). doi:10.1007/s10549-024-07420-9
癌细胞是一种非常聪明的细胞,因此其能找到新方法来对这些抑制剂的杀伤效应产生耐受性,其不再会被抑制剂所杀死,而是会存活更长时间。研究人员分析了这些细胞所发生的改变,这些改变能使其在抑制剂存在的情况下适应和生存,让研究者出乎意料的是,全局RNA基因分析结果表明,在ER阳性和三阴性乳腺癌细胞中,对FOXM1抑制剂的耐受性或许会伴随着铁死亡抑制基因水平的升高。
这或许就表明,对FOXM1抑制剂的获得性耐受性或许能通过铁死亡的诱导剂来逆转,铁死亡是一类依赖铁的程序性细胞死亡形式,癌细胞的代谢活性高度依赖于铁。研究者表示,这或许就促使他们进一步研究敏感细胞和对抑制剂产生耐受性的细胞中铁死亡的状态;从他们所做的每一个实验中,他们都能学到新的知识,并从新的角度来看待问题。尽管相关研究发现需要在体内动物模型中进一步分析检验,但研究人员希望能利用铁死亡激活剂来作为一种有效的工具,从而治疗多种类型癌症,并增强FOXM1抑制的治疗反应。
目前研究人员正在对类器官进行研究,类器官是一种多细胞且能更多模拟癌症可能发生的自然乳腺环境;在此基础上,下一步研究人员将会进行安全性和有效性的相关临床试验。综上,本文研究结果表明,揭示能克服药物耐受性的活性和细胞死亡通路的改变,或许能帮助确定可能能最好地预防或逆转对FOXM1治疗靶向性耐药的手段,从而就有望最终改善癌症患者的临床治疗结局。(100yiyao.com)
参考文献:
Kumar, S., Ziegler, Y., Plotner, B.N. et al. . Breast Cancer Res Treat (2024). doi:10.1007/s10549-024-07420-9
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 低剂量维生素E也能治疗脂肪肝?中国研究证实,有效且更安全 (2025-02-24)
- Nat Genet:在人体中发现一种新的脂肪细胞亚型,有可能推进个性化的肥胖治疗 (2025-02-24)
- Cell Rep:揭示肺部中的CD4+TRM细胞亚群调节中性粒细胞哮喘发生机制 (2025-02-24)
- 工作时的体力劳动和空闲时的锻炼有区别?AJPM:别让工作累垮你!空闲时间锻炼才是预防2型糖尿病的关键 (2025-02-24)
- 北京大学最新Cell论文:李龙/宋晨/高宁团队揭示膜蛋白进入脂膜折叠的分子过程 (2025-02-23)
- Nature:当癌症疫苗遇上"癌王"!一场改写生命剧本的细胞革命 (2025-02-23)
- Nature Methods:窥探生命的分子之舞——PTEN活体成像技术开启神经科学新纪元 (2025-02-23)
- Science:复旦大学郁金泰团队发现帕金森病全新治疗靶点,并利用AI找到潜在治疗药物 (2025-02-22)
- 迈威生物于国际权威期刊发表自主研发的靶向整合素 αvβ8 抗体的临床前研究成果 (2025-02-22)
- 抵御流感的秘密武器!Nat Immunol:来自真菌中的β (2025-02-22)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















