《癌症通讯》:一旦感染,阴魂不散!新桥医院团队首次发现,幽门螺杆菌能将促癌“写入”宿主细胞基因组 |
 |
《癌症通讯》:一旦感染,阴魂不散!新桥医院团队首次发现,幽门螺杆菌能将促癌“写入”宿主细胞基因组
来源:奇点糕 2025-02-24 10:54
这项研究揭示了幽门螺杆菌促胃癌的新机制。这一发现不仅表明FTO抑制剂是治疗胃癌的潜在药物,还从表观遗传学的角度给CagA诱导胃癌发展的“hit-and-run”假说,提供了有力的支撑证据。众所周知,与密切相关。
有研究认为,约90%的非贲门胃癌可归因于幽门螺杆菌感染[1]。
至于幽门螺杆菌诱发胃癌的机制,科学家做了很多探索。总体来说,受幽门螺杆菌的毒力因子和宿主的遗传特征共同影响。
从幽门螺杆菌的角度来看,细胞毒素相关基因A(CagA)蛋白等毒力因子,在被注射到宿主细胞之后,会激活一连串的致癌信号通路,最终导致胃癌的发生。
虽然已经有大量前瞻性研究和荟萃分析表明,根除幽门螺杆菌可降低患胃癌的风险;但是也有一些研究发现,对于出现胃黏膜肠上皮化生等情况的人而言,根除幽门螺杆菌不能降低胃癌的发生[2,3]。
此外,,但是没有显著降低胃癌相关死亡风险[4]。

上述这些发现,让人想起幽门螺杆菌促胃癌的一个假说 hit-and-run 。对应的中文可以理解为 一击即脱 、 打了就跑 或者 短时触发-持续致癌 。
这个假说认为,即使根除了幽门螺杆菌,可能也没办法阻止胃癌的进展[5,6]。换成更易懂的人话就是, 一旦感染,阴魂不散 (感觉还能押韵 hit-and-run )。
只不过,这个假说目前还需要机制层面的证据支撑。
今天,由陆军军医大学第二附属医院(新桥医院)杨仕明和肖煜峰领衔的研究团队,在著名期刊Cancer Communications上发表了一篇重要论文[7],给 hit-and-run 假说提供了强有力的理论支撑。
他们发现能产生毒力因子CagA的幽门螺杆菌,会通过释放CagA,促进去甲基化酶FTO的表达,导致肝素结合性表皮生长因子(HBEGF)mRNA的m6A甲基化水平降低和稳定性提升,进而促进胃的上皮间质转化(EMT),推动胃癌的进展。
尤其值得注意的是,即使根除幽门螺杆菌,也无法逆转FTO和HBEGF的水平升高。简单来说,即使清除了幽门螺杆菌,它导致的宿主细胞表观遗传学变化也没办法逆转了。

▲论文首页截图
在研究之初,杨仕明团队就将研究重心放在了N6-甲基腺苷(m6A)上。因为m6A是一种重要的mRNA表观遗传学修饰,调控mRNA的稳定性、翻译和剪接等重要过程,与癌症的发生发展密切相关,而且还受微生物的影响。
他们先分析了胃癌组织的m6A水平,发现在毒力因子CagA阳性的胃癌样本中,mRNA的m6A水平显著降低。幽门螺杆菌感染实验也显示,被产生CagA的幽门螺杆菌感染的细胞m6A水平较低。
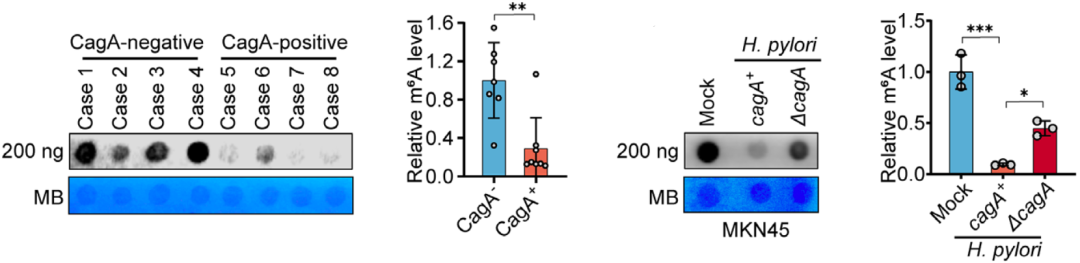
▲CagA与m6A水平负相关
很显然,幽门螺杆菌产生的CagA影响了宿主细胞mRNA的m6A水平。
那么发挥作用的去甲基化酶是谁呢?
实际上,之前已经有研究发现去甲基化酶FTO的水平受CagA的影响。在这个研究中,杨仕明团队也发现,CagA阳性的胃癌组织中FTO的表达水平显著更高。细胞实验和人类研究队列的数据,都证实CagA会诱导去甲基化酶FTO的表达。
基于此,他们又在人类数据库中探索了FTO表达水平与癌症之间的关系。研究结果表明,与正常胃组织相比,胃癌组织的FTO表达显著增加。此外,FTO的mRNA水平与淋巴结转移、远处转移和肿瘤分期等主要临床病理特征之间存在相关性;而且FTO高表达的胃癌患者的总生存率显著低于FTO低表达的患者。
到这里就可以说,幽门螺杆菌产生的毒力因子CagA,上调了去甲基化酶FTO,进而促进胃癌的进展。
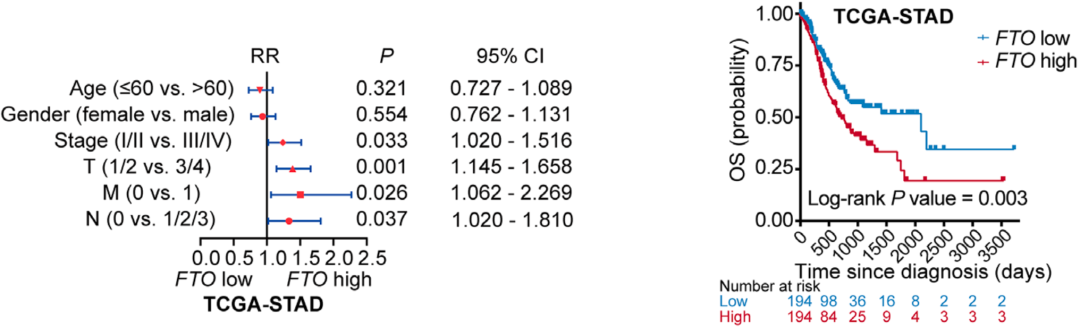
▲FTO水平高,胃癌患者预后不好
那么这一切是如何发生的呢?
杨仕明团队深入揭示了背后的分子机制。
他们发现,幽门螺杆菌将毒力因子CagA注入宿主细胞之后,会通过MAPK通路上调JUN的表达,进而提升FTO基因启动子的活性,提升FTO的水平;随后FTO发挥去甲基化作用,降低了肝素结合性表皮生长因子(HBEGF)mRNA的m6A甲基化水平,导致HBEGF的mRNA更稳定(免于被YTHDF2破坏),合成更多的HBEGF,进而促进胃癌细胞的上皮间质转化(EMT),最终推动胃癌的进展。
遗憾的是,即使用去除幽门螺杆菌,FTO和HBEGF的水平也没有恢复到正常水平,而是保持升高的状态。
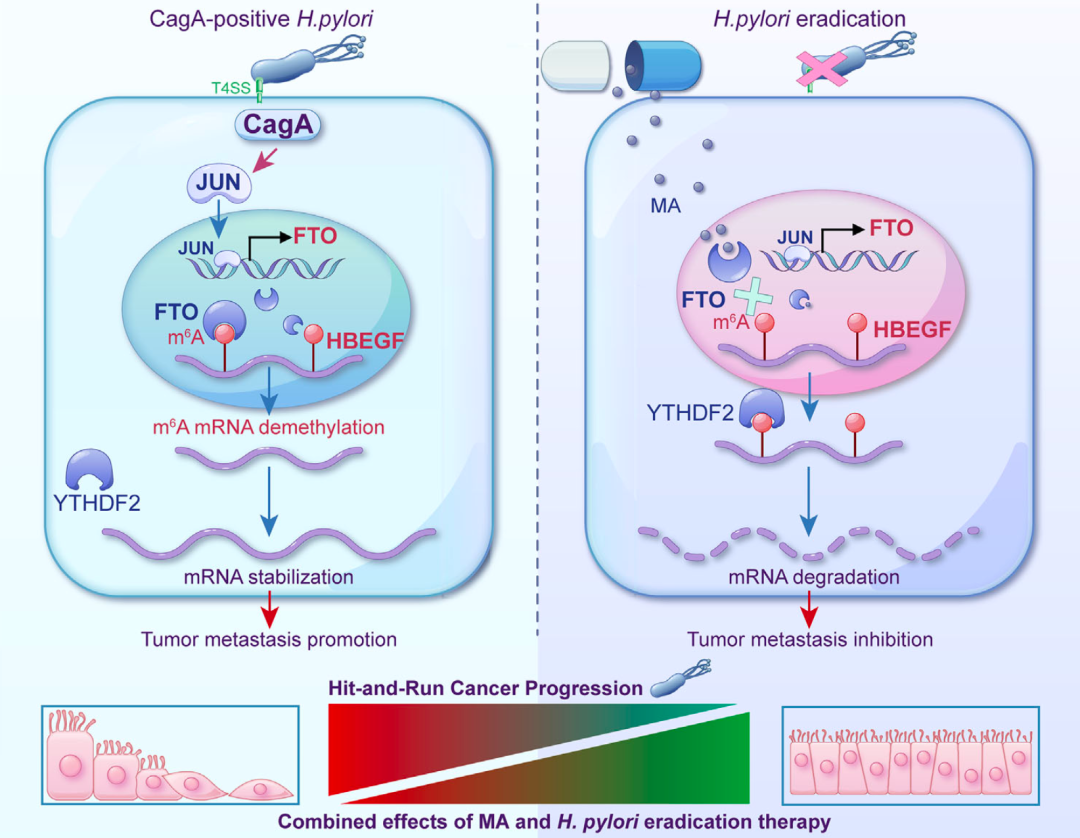
▲机制示意图
既然幽门螺杆菌毒力因子CagA调控的表观遗传学变化,在胃癌的进展中发挥着重要的作用,而且这种表观遗传学变化不能通过清除幽门螺杆菌逆转;于是,杨仕明团队就想到,在清除幽门螺杆菌的同时,抑制FTO的活性,或许可以抑制胃癌的进展。
因此,他们将已经获得美国批准的非甾体抗炎药、FTO抑制剂甲氯芬那酸(MA)与抗生素联用,结果显示,m6A水平被提升,HBEGF的表达被抑制,胃癌细胞的迁移和侵袭能力也被削弱(上皮间质转化被抑制)。
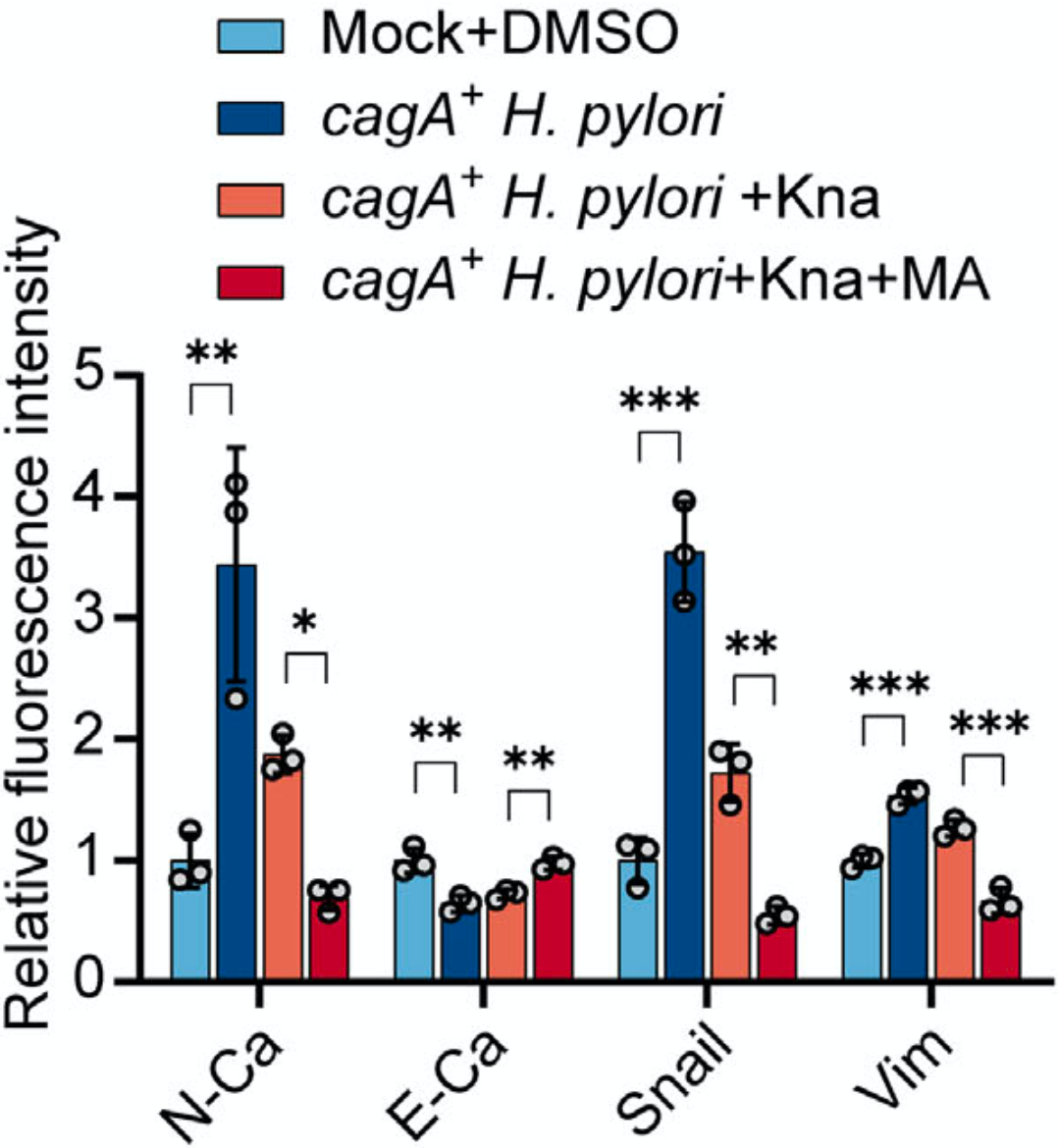
▲甲氯芬那酸(MA)与抗生素联用,抑制了上皮间质转化
在研究的最后,杨仕明团队又基于小鼠模型,在体内证实了上述机制的存在。
总的来说,杨仕明/肖煜峰团队这项研究成果,揭示了幽门螺杆菌促胃癌的新机制。这一发现不仅表明FTO抑制剂是治疗胃癌的潜在药物,还从表观遗传学的角度给CagA诱导胃癌发展的 hit-and-run 假说,提供了有力的支撑证据。
值得注意的是,虽然已经有研究发现,但是目前还没有临床研究发现甲氯芬那酸(MA)与胃癌之间的关系。因此,未来有必要基于临床数据开展进一步的研究。
参考文献:
[1].Moss SF. The Clinical Evidence Linking Helicobacter pylori to Gastric Cancer. Cell Mol Gastroenterol Hepatol. 2016;3(2):183-191. Published 2016 Dec 27. doi:10.1016/j.jcmgh.2016.12.001
[2].Rokkas T, Pistiolas D, Sechopoulos P, Robotis I, Margantinis G. The long-term impact of Helicobacter pylori eradication on gastric histology: a systematic review and meta-analysis. Helicobacter. 2007;12 Suppl 2:32-38. doi:10.1111/j.1523-5378.2007.00563.x
[3].Chen HN, Wang Z, Li X, Zhou ZG. Helicobacter pylori eradication cannot reduce the risk of gastric cancer in patients with intestinal metaplasia and dysplasia: evidence from a meta-analysis. Gastric Cancer. 2016;19(1):166-175. doi:10.1007/s10120-015-0462-7
[4].Pan KF, Li WQ, Zhang L, et al. Gastric cancer prevention by community eradication of Helicobacter pylori: a cluster-randomized controlled trial. Nat Med. 2024;30(11):3250-3260. doi:10.1038/s41591-024-03153-w
[5].Hatakeyama M. Helicobacter pylori CagA and gastric cancer: a paradigm for hit-and-run carcinogenesis. Cell Host Microbe. 2014;15(3):306-316. doi:10.1016/j.chom.2014.02.008
[6].Imai S, Ooki T, Murata-Kamiya N, et al. Helicobacter pylori CagA elicits BRCAness to induce genome instability that may underlie bacterial gastric carcinogenesis. Cell Host Microbe. 2021;29(6):941-958.e10. doi:10.1016/j.chom.2021.04.006
[7].He B, Hu Y, Wu Y, et al. Helicobacter pylori CagA elevates FTO to induce gastric cancer progression via a "hit-and-run" paradigm. Cancer Commun (Lond). Published online February 17, 2025. doi:10.1002/cac2.70004
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- HICOOL 2025峰会聚焦:签约央企国家队、首发新品、启动国际联合体,国典医药奏响再生医学“三重奏” (2025-10-23)
- 2025年福建省药品检验技能比武圆满收官 (2025-10-23)
- 引领医药项目管理迈向新高度--第二届中国医药企业项目管理大会定于11月在京召开 (2025-10-23)
- 牙周炎伴牙龈萎缩:8款医用级修复解决方案权威推荐 (2025-10-23)
- 辽宁:2025年11月1日起全面完成生养津贴发放至团体 (2025-10-23)
- 放射科与分研院联合研究成果发表于Science子刊,为动脉粥样硬化诊疗开辟新路径 (2025-10-23)
- 用药更少、服用更不便:我国幽门螺杆菌根除医治研讨取得新突破 (2025-10-23)
- 醉酒后光止吐没用!GFX 护肝胶囊用实力护肝脏 (2025-10-23)
- Nat Biotechnol:给免疫细胞“写记忆”!科学家发明不伤DNA的基因开关,抗癌能力有望持久升级 (2025-10-23)
- 《神经病学年鉴》:评估一个简单的转身动作,或可提前8.8年预测帕金森病! (2025-10-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















