Nat Commun:体外分解的Aβ卵白在构造上分歧于阿尔茨海默病患者脑源性Aβ卵白 |
 |
2019年11月17日讯/BIOON/---阿尔茨海默病(AD)是一种停止性神经退行性疾病,其特点在于Aβ淀粉样卵白原纤维(也称为Aβ原纤维)和tau卵白衍素性的神经原纤维缠结物在神经元中堆积。一些不雅察成果标明Aβ肽关于触发疾病发生发火至关主要。Aβ前体卵白(APP)编码基因的异常反复,以及APP基因或介入加工的酶编码基因产生的渐变可招致阿尔茨海默病。Aβ肽及其相干原纤维构成的本质斑块和血管淀粉样卵白堆积物可招致脑淀粉样血管病(cerebral amyloid angiopathy, CAA)。Aβ堆积物可包括Aβ肽的分歧一级构造变体。人们已对40和42个氨基酸残基的Aβ肽变体Aβ(1-40)和Aβ(1-42)停止了极端深化的研讨。固然Aβ(1-42)肽被以为是经过构成有毒的原纤维而致病的,然则Aβ(1-40)会构成了原纤维堆积物,从而对脑血管壁形成毁伤。
以后关于Aβ肽的很多常识源自对Aβ原纤维和其他集合物的剖析,这些集合物是由体外化学分解或重组表达的Aβ肽构成的。这些源自试管的Aβ集合物平日富含β-折叠层。Aβ原纤维具有穿插β构造和对刚果红的亲和力,相似于从患者组织中纯化的淀淀粉样卵白原纤维。体外构成的Aβ原纤维具有高度多态性,而且在由分歧的Aβ肽变体构成的或在分歧的原纤维构成前提下构成的分歧原纤维形状中发明了一系列分歧的肽构象。但是,到今朝为止,尚不清晰这些构造中的哪些或这些构造中的任何一种能否准确反应了年夜脑外部的Aβ肽致病性构造。
在一项新的研讨中,来自德国乌尔姆年夜学和图宾根年夜学等研讨机构的研讨人员剖析了来自AD年夜脑组织的Aβ淀粉样卵白纤维的构造形状。他们发明脑源性Aβ原纤维由多种原纤维形状构成。在原纤维形状I的情形下,他们取得了肯定Aβ肽折叠的构造模子:依据两个雷同的肽客栈(peptide stack)的存在、右手歪曲原纤维、假21螺旋对称性和原纤维极性,原纤维停止分层拆卸。相干研讨成果近期揭橥在Nature Communications期刊上,论文题目为“Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue”。
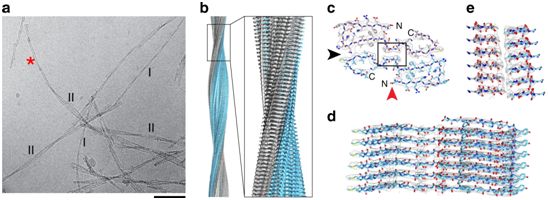 图片来自Nature Communications, 2019, doi:10.1038/s41467-019-12683-8。
这种模子的稳健性经过它与获得试验验证的二维类均匀值(2D class averages)和功率谱(power spectra)的对应关系、与3D图谱比拟时的傅里叶壳层联系关系(Fourier shell correlation, FSC)值4.5和照实反应脑源性原纤维的右手歪曲拓扑构造的Ψ/Φ角散布获得证明。但是,这种模子在多肽主链和氨基酸侧链的具体几何外形方面仍存在不肯定性。这项研讨中不雅察到的C形肽折叠是新鲜的,分歧于先前对体外构成的Aβ构造的描绘。这种原纤维构造的共同特点是N末尾弓形构造和氨基酸残基24-26处于中间地位,这分歧于先前描绘的Aβ原纤维:氨基酸残基30-42构成最中间的构造元素。
图片来自Nature Communications, 2019, doi:10.1038/s41467-019-12683-8。
这种模子的稳健性经过它与获得试验验证的二维类均匀值(2D class averages)和功率谱(power spectra)的对应关系、与3D图谱比拟时的傅里叶壳层联系关系(Fourier shell correlation, FSC)值4.5和照实反应脑源性原纤维的右手歪曲拓扑构造的Ψ/Φ角散布获得证明。但是,这种模子在多肽主链和氨基酸侧链的具体几何外形方面仍存在不肯定性。这项研讨中不雅察到的C形肽折叠是新鲜的,分歧于先前对体外构成的Aβ构造的描绘。这种原纤维构造的共同特点是N末尾弓形构造和氨基酸残基24-26处于中间地位,这分歧于先前描绘的Aβ原纤维:氨基酸残基30-42构成最中间的构造元素。
形状I中的Aβ肽折叠与在原纤维形状II和III时取得的三维图谱十分吻合。虽然前面两种形状下的三维图谱具有比形状I更低的分辩率,然则很分明,在这一切三种原纤维形状中,普通的原纤维构造都是保守的,而且它们的次要差别是原纤维的数目。这三种原纤维形状占这项研讨中应用的样品中可见原纤维的年夜部门,这标明这种描绘的构造代表了来自患者年夜脑的Aβ淀粉样原纤维。在这项研讨平分析的一切三名AD患者的原纤维提取物中分歧地发明了这三种原纤维形状。不外,不克不及扫除其他Aβ原纤维形状也能够存在于年夜脑中,比方在受某些Aβ肽变体影响的患者年夜脑中。
人们已在Aβ肽序列中发明14种渐变。据报道,个中的十二种渐变可增进AD和/或CAA,而Ala2Thr渐变具有维护性,His6Arg渐变具有不肯定的相干性。经过对应到这项研讨描绘的构造上,年夜多半渐变都没有分明的波动或不波动感化。该不雅察成果与研讨分歧,后者标明它们能够会影响Aβ肽的卵白水解生成。或许,某些渐变能够只是在全体上复杂地增进集合而不是针关于特定的原纤维形状。只要三种渐变会引诱或去除接触,它们能够会毁坏这种构造的波动性:Glu11Lys和Lys16Asn毁坏了N末尾弓形构造内的盐桥,而Leu34Val除去了C末尾弓形构造内的亚甲基。但是,前两种渐变被描绘为对Aβ的卵白水解进程起感化,尔后一种渐变增进而不是阻拦CAA。
这项研讨不雅察到的脑源性原纤维的一个特殊风趣的构造特点是它们的右手歪曲。这种性质激烈分歧于先前描绘的体外构成的Aβ(1–40)和Aβ(1–42)原纤维的左手歪曲,并且更分明的是,也明显分歧于对反向歪曲的β-折叠片表示出激烈偏心性的球形卵白质构造。这项新的研讨发明了第二种与体内右手歪曲的淀粉样卵白原纤维相干的人致病性原纤维卵白。第一种是人类零碎性AA淀粉样变性病中罕见的血清淀粉样卵白A(serum amyloid A protein)变体。虽然这种右手歪曲的分子来源尚待肯定,然则Aβ和AA淀粉样卵白原纤维的拉马钱德兰图(Ramachandran plot)中的Ψ/Φ对散布暗示着原纤维卵白的折叠引诱了右手歪曲。与这种不雅点相分歧的是,这项研讨中描绘的Aβ折叠与先前描绘的左手歪曲的Aβ原纤维中不雅察到的Aβ肽折叠根本分歧。
医药网新闻
- 相关报道
-
- 诺华签约参展明年第九届进博会,成为首批九年"全勤生" (2025-07-28)
- 清华大学开发AI大模型,准确预测人类衰老,登上医学顶刊Nature Medicine (2025-07-28)
- 槲皮素哪个牌子效果最好?2025十大槲皮素排名公布,第一花落谁家 (2025-07-28)
- 研究揭示乙肝相关慢加急性肝衰竭进展的新机制 (2025-07-27)
- Cell:刘光慧团队等发现50岁是人类衰老转折点,血管系统首当其冲 (2025-07-27)
- Cell:基因魔剪再进化_一针逆转“交替性偏瘫”,为罕见病患儿点亮希望之光 (2025-07-26)
- JACS Au:新型分子降解剂有望治疗侵袭性乳腺癌 (2025-07-26)
- 药明康德高管:赋能创新转化,需要的不仅是科学本身 (2025-07-25)
- PCF®技术——生物智造领域人类新质生产力 (2025-07-25)
- 马来西亚医疗旅游理事会推出MYMT 2026,打造马来西亚首个医疗旅游年 (2025-07-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















