第5款阿达木单抗生物仿造药!辉瑞Abrilada (adalimumab |
 |

2019年11月19日/BIOON/--辉瑞(Pfizer)研制的一款生物相似药Abrilada (adalimumab-afzb,阿达木单抗)近日取得美国FDA同意,该药是艾伯维旗舰产物修美乐(Humira,通用名:adalimumab,阿达木单抗)的生物仿造药,用于医治多种本身免疫性疾病,包含:类风湿性关节炎(RA)、少小特发性关节炎(JIA)、银屑病关节炎(PsA)、强直性脊柱炎(AS)、成人克罗恩病(CD)、溃疡性结肠炎(UC)、斑块型银屑病。
此次FDA同意,基于对一个综合数据包的审查,该数据包证实了Abrilada绝对于参考药物Humira的生物类似性。个中包含REFLECTIONS B538-02临床比较研讨的成果。这是一项随机、双盲、平行组III期临床研讨,在承受甲氨蝶呤(MTX)医治缓解缺乏的中度至重度运动性类风湿性关节炎(RA)患者中展开,评价了Abrilada皮下打针用药(每隔一周皮下打针40mg)结合甲氨蝶呤医治计划绝对于Humira皮下打针用药(每隔一周皮下打针40mg)结合甲氨蝶呤医治计划的疗效、平安性及免疫原性。成果显示,Abrilada与Humira在疗效、平安性、免疫原性方面没有发明有临床意义的差别。
截至今朝,FDA共同意了25个生物仿造药。Abrilada是在2019年同意的第9个生物仿造药,也是该机构迄今为止同意的第5个阿达木单抗。
除了辉瑞Abrilada之外,其他4款已同意的阿达木单抗辨别为:Hadlima(三星Bioepis/默沙东,2019年7月)、Hyrimoz(山德士,2018年10月)、Cyltezo(勃林格殷格翰,2017年8月)、Amjevita(安进,2016年9月)。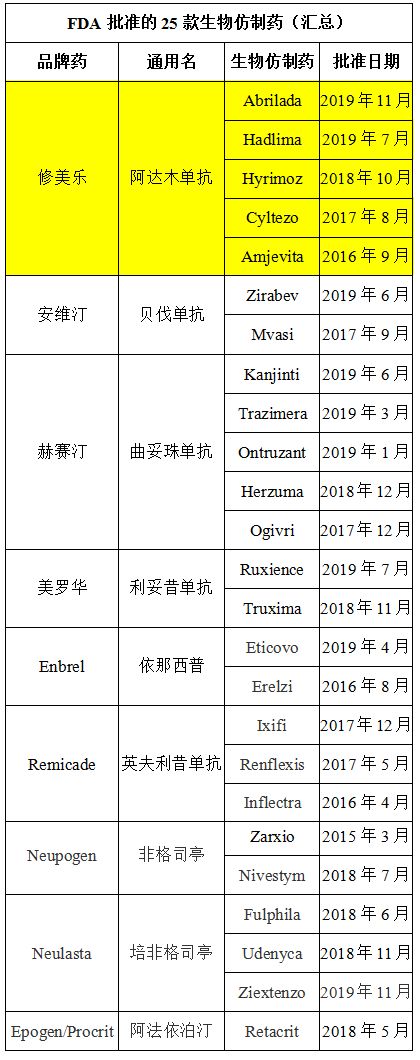
Humira作为艾伯维的旗舰产物,是全球第一个获批的抗坏逝世因子TNF-α药物,该药也是全球最滞销的抗炎药,自上市以来,今朝已获全球90多个国度同意,获批达10多个顺应症,包含:类有、少小特发性关节炎、银屑病关节炎、强直性脊柱炎、成人克罗恩病、小儿克罗恩病、溃疡性结肠炎、银屑病、化脓性汗腺炎和葡萄膜炎。
Humira是艾伯维的一款超等重磅产物,持续数年稳坐全球“药王”宝座,2018年全球发卖额高达199.36亿美元,个中美国市场净支出136.85亿美元、国际市场净支出62.51亿美元(年夜部门来自欧洲)。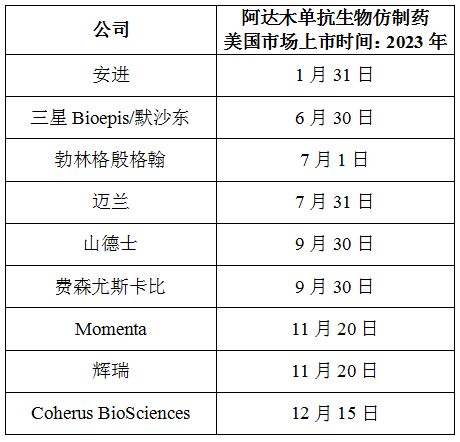
在欧洲,今朝已有多款阿达木单抗在欧洲上市,但在美国市场,艾伯维已先后与9家制药公司杀青息争协定,包含:安进、三星Bioepis/默沙东、迈兰、山德士、费森尤斯卡比(Fresenius Kabi)、Momenta、辉瑞、Coherus BioSciences、勃林格殷格翰。
依据协定条目,这些公司的阿达木单抗可在2023年的分歧工夫点上岸美国市场,而且不会由于其他已受权公司产物的上市而提早上市。(100医药网100yiyao.com)
原文出处:
医药网新闻
- 相关报道
-
- 中国科学院发表人工智能机器人最新Cell论文 (2025-08-14)
- Nature Methods:“鱼”与“熊掌”兼得?!MAPIT-seq,同时绘制单细胞RBP-RNA互作图谱与表达谱 (2025-08-14)
- JACC:清洁空气,可降血压!最新临床研究表明,家用HEPA空气净化器可显著降低收缩压升高人群的血压 (2025-08-14)
- 两篇《科学》齐发!食物过敏的背后机制找到了 (2025-08-13)
- 抑郁症治疗新方法:陈跃军/熊曼团队利用人类干细胞来源的A10亚型多巴胺能神经元改善抑郁症 (2025-08-13)
- Science:既是“脚手架”也是“束缚衣”——神经元为何必须动态重塑其周期性骨架 (2025-08-13)
- Cell Death and Disease:类器官模型揭示 ULBP2 CAR-T 细胞对胃癌的杀伤作用 (2025-08-12)
- Cell子刊:华人团队开发新型微针贴片,促进心肌梗塞后的心脏修复 (2025-08-12)
- 颜宁团队发表最新PNAS论文:助力心脏病及抗癫痫/镇痛药物精准设计 (2025-08-12)
- STTT:湖北工业大学团队发现“癌王”进展新机制和治疗新靶点! (2025-08-12)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















