2019年11月Cell期刊不得不看的亮点研讨 |
 |
2019年11月30日讯/BIOON/---2019年11月份行将停止了,11月份Cell期刊又有哪些亮点研讨值得进修呢?小编对此停止了整顿,与列位分享。
1.
doi:10.1016/j.cell.2019.10.031
我们平日以为饱腹感会让我们停滞进食。不外,在一项新的研讨中,来自美国加州年夜学旧金山分校等研讨机构的研讨人员发明肠道的拉伸能够在让我们觉得饱腹感方面发扬了更年夜的感化。相干研讨成果揭橥在2019年11月14日的Cell期刊上,论文题目为“Genetic Identification of Vagal Sensory Neurons That Control Feeding”。论文通信作者为加州年夜学旧金山分校神经迷信家Zachary Knight博士。
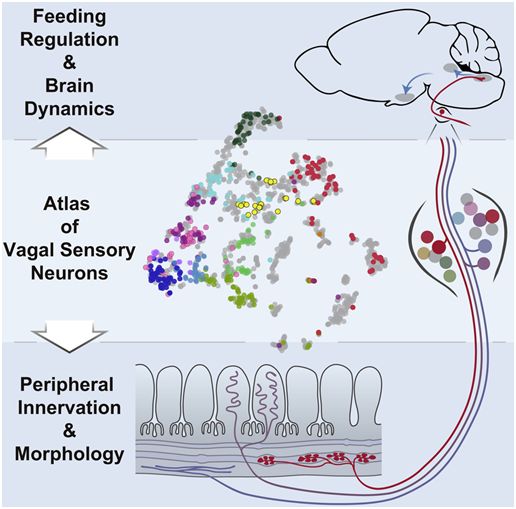 图片来自Cell, 2019, doi:10.1016/j.cell.2019.10.031。
你的肠道里散布着年夜量的神经末梢,它们在掌握你的食量方面起侧重要的感化。这些神经末梢监控着胃部和肠道的内含物,然后向年夜脑发送旌旗灯号,增进或下降你的食欲。年夜多半迷信家以为,这种反应触及肠道中对激素敏感的神经末梢,这些神经末梢会追踪你摄入的养分物并盘算你什么时分吃饱了,但迄今为止没有人追踪向年夜脑传递这些旌旗灯号切实其实切神经元类型。答复这个成绩的挑衅之一是数以千计的感到神经(sensory nerve)介入搜集来自胃部和肠道的感到信息,它们存在很多分歧的类型,然则它们都经过一种宏大的称为迷走神经(vagus nerve)的神经束将信息传递回年夜脑。迷信家们可以阻断或安慰这种神经束的运动并改动植物的食欲,然则若何找出是哪个迷走神经末梢惹起了这种变更呢?
图片来自Cell, 2019, doi:10.1016/j.cell.2019.10.031。
你的肠道里散布着年夜量的神经末梢,它们在掌握你的食量方面起侧重要的感化。这些神经末梢监控着胃部和肠道的内含物,然后向年夜脑发送旌旗灯号,增进或下降你的食欲。年夜多半迷信家以为,这种反应触及肠道中对激素敏感的神经末梢,这些神经末梢会追踪你摄入的养分物并盘算你什么时分吃饱了,但迄今为止没有人追踪向年夜脑传递这些旌旗灯号切实其实切神经元类型。答复这个成绩的挑衅之一是数以千计的感到神经(sensory nerve)介入搜集来自胃部和肠道的感到信息,它们存在很多分歧的类型,然则它们都经过一种宏大的称为迷走神经(vagus nerve)的神经束将信息传递回年夜脑。迷信家们可以阻断或安慰这种神经束的运动并改动植物的食欲,然则若何找出是哪个迷走神经末梢惹起了这种变更呢?
为懂得决这个谜团,Knight及其团队(包含论文第一作者Ling Bai博士)片面绘制了散布在胃部和肠道中的迷走感到细胞类型神经元的分子息争剖学特点。他们绘制出的图谱许可人们选择性地安慰小鼠中分歧类型的迷走神经元,从而提醒出肠道拉伸传感器(intestinal stretch sensor)可以阻拦饥饿的小鼠进食。
2.
doi:10.1016/j.cell.2019.10.029
在一项新的研讨中,来自美国德克萨斯年夜学MD安德森癌症中间的研讨人员报道分散到骨骼的前列腺癌会激发骨组织毁坏,进而障碍T细胞的发育,这就会毁坏免疫反省点克制剂的无效性,究竟T细胞对医治的胜利至关主要。这一发明提醒了为何免疫疗法在很年夜水平上不克不及胜利医治前列腺癌骨转移,并指出能够逆转这种抵御性的组合医治。相干研讨成果揭橥在2019年11月14日的Cell期刊上,论文题目为“Differences in Tumor Microenvironment Dictate T Helper Lineage Polarization and Response to Immune Checkpoint Therapy”。论文通信作者为德克萨斯年夜学MD安德森癌症中间生殖泌尿医学肿瘤学传授、免疫学传授Padmanee Sharma博士。
Sharma及其研讨团队发明由肿瘤惹起的骨骼毁坏招致年夜量发生转化发展因子-β(TGF-β),这种卵白可招致帮助性T细胞(Th细胞)极化为Th17 CD4细胞,而不是触发抗肿瘤免疫反响所需的Th1 CD4效应细胞。骨髓中Th1细胞的缺少标明骨微情况中的细胞因子谱分歧。Sharma团队剖析了小鼠的荷瘤股骨和无肿瘤股骨中13种细胞因子的程度。他们发明TGF-β的明显降低可以克制Th1细胞谱系并增进Th17细胞和Treg细胞的发生。Th17细胞还须要IL-6的存在,正如预期的那样,IL-6在骨髓中的含量很高。
骨转移触发了异常的骨骼重塑,而且骨成分被称为TGF-β的次要贮存库。Sharma团队猜想骨基质重塑招致前列腺骨转移中的较高TGF-β程度。他们的试验证明,被肿瘤激活的破骨细胞在腐蚀骨骼外表的同时释放出过量的TGF-β。
为了在人体中测试这种猜想,他们比拟了安康供者和有或没有骨转移的前列腺癌患者的骨髓中的TGF-β程度。安康对比者和没有骨转移的患者之间的TGF-β程度没有差别,而产生骨转移的患者的骨骼中TGF-β异常高。
3.
doi:10.1016/j.cell.2019.10.028
美国食物药物治理局(FDA)近期同意了结合应用免疫医治药物和化疗药物用于医治三阴性乳腺癌,但是并非一切的这种侵袭性乳腺癌病例在临床研讨中都作出反响。在一项新的研讨中,来自美国北卡罗来纳年夜学等研讨机构的研讨人员发明了一些生物学线索,它们可用于协助判定对激活免疫零碎对立癌症的药物作出反响的侵袭性乳腺癌。他们的发明是经过对小鼠停止研讨和对来六项临床实验的数据停止剖析取得的。假如在将来的研讨中获得证明的话,那么这些新见地能够有助于指点患者停止准确的医治,从而让这些患者远离有效的医治。这也能够招致一种让药物在最后没有反响的癌症中起感化的办法。相干研讨成果揭橥在2019年11月14日的Cell期刊上,论文题目为“B Cells and T Follicular Helper Cells Mediate Response to Checkpoint Inhibitors in High Mutation Burden Mouse Models of Breast Cancer”。
医药网新闻
- 相关报道
-
- Cell:基因魔剪再进化_一针逆转“交替性偏瘫”,为罕见病患儿点亮希望之光 (2025-07-26)
- JACS Au:新型分子降解剂有望治疗侵袭性乳腺癌 (2025-07-26)
- 药明康德高管:赋能创新转化,需要的不仅是科学本身 (2025-07-25)
- PCF®技术——生物智造领域人类新质生产力 (2025-07-25)
- 马来西亚医疗旅游理事会推出MYMT 2026,打造马来西亚首个医疗旅游年 (2025-07-25)
- “十四五”以来,医保基金累计收入12.13万亿元,年均增速9.1% (2025-07-25)
- 《柳叶刀》子刊:复发风险减半!研究表明,抗抑郁药和氯氮平联用与难治性精神分裂症的复发风险降低51%有关 (2025-07-25)
- 槲皮素哪个牌子效果最好?2025年全球十大槲皮素护肺品牌成分、技术、口碑、临床数据深度评测 (2025-07-25)
- 护肺选对不选贵!槲皮素哪个牌子效果最好?成分、技术全面剖析 (2025-07-25)
- 深度溯源有机品质,第二届717龙凤堂有机黄芪节在固阳举办 (2025-07-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |
|


















