B细胞肿瘤靶向新药!MEI/协和麒麟合作开发PI3Kδ抑制剂MEI |
 |

2020年04月26日讯 /BIOON/ --MEI Pharma是一家处于后期临床阶段的生物制药公司,致力于开发用于癌症治疗的创新疗法。近日,该公司宣布与日本药企协和麒麟(Kyowa Kirin)签订了一项全球许可、开发和商业化协议,以进一步开发和商业化ME-401。该药是一种口服选择性磷脂酰肌醇-3-激酶δ(PI3Kδ)抑制剂,开发用于B细胞恶性的治疗。
此次协议实质上保留并巩固了双方在2018年签订的在日本开发和商业化MEI-401的许可协议条款。根据最新的协议条款,在美国,MEI和协和麒麟将共同开发和推广ME-401,双方将以50-50平摊成本和利润。在美国以外地区,协和麒麟拥有独家商业化权利,MEI将有资格获得逐渐递增的分层特许权使用费。MEI将获得1亿美元的预付现金,并有资格获得基于特定开发、监管、商业里程碑的总额高达5.825亿美元的里程碑款项。双方已同意了一项开发计划,广泛评估ME-401治疗各种B细胞恶性,包括与其他药物的联合应用。
ME-401是一款在研口服磷脂酰肌醇3-激酶(PI3K)δ抑制剂,目前正处于临床开发,评估治疗多种B细胞恶性肿瘤。PI3Kδ抑制剂通常在癌细胞中过度表达,并在血液肿瘤的增殖及存活中起着关键作用。ME-401对PI3Kδ亚型呈现出很高的选择性,且与其他PI3Kδ抑制剂具有不同的药物特性,该药具有成为同类最佳(best-in-class)PI3Kδ抑制剂的潜力。其临床特征表明,作为一种单药疗法或与其他癌症药物联合用药,有机会解决一系列B细胞恶性。
今年3月底,美国授予了MEI-401快速通道资格(FTD),用于治疗已接受至少2种系统疗法的复发或难治性滤泡性淋巴瘤(R/R FL)成人患者。目前,MEI公司正在开展一项全球性II期TIDAL,评估ME-401作为单药疗法用于已接受过至少2种系统疗法(包括化疗和抗CD20抗体)治疗失败的R/R FL成人患者。该试验的结果,将用于支持向美国申请加速批准ME-401上市。
MEI-401的差异化特征
除了TIDAL试验之外,MEI公司也正在开展一项多臂、开放标签、Ib期剂量递增和扩展试验,评估ME-401作为单药疗法、与其他疗法(如利妥昔单抗)或药物(如Brukinsa[zanubrutinib,泽布替尼],百济神州BTK抑制剂)联合用药,治疗复发或难治性B细胞恶性,包括滤泡性淋巴瘤(FL)、慢性淋巴细胞/小细胞淋巴瘤(CLL/SLL)、边缘区淋巴瘤(MZL)、套细胞淋巴瘤(MCL)、弥漫性大B细胞淋巴瘤(DLBCL)。此外,MEI公司在2019年还启动了一项I期试验,评估MEI-401作为一种单药疗法,治疗日本惰性B细胞恶性患者。
MEI首席运营官兼总法律顾问David M.Urso表示:“与协和麒麟的全球合作是实现我们广泛开发和商业化ME-401目标的关键一步,将优化在美国内外多种B细胞恶性患者受益的机会,也为我们的股东创造价值。我们决定扩大与协和麒麟的联盟,是基于我们迄今为止根据2018年日本许可协议建立的成功合作关系,以及我们对协和麒麟的尊重,以及他们在美国和世界各地共同执行我们对ME-401共同愿景的能力。”
协和麒麟战略产品规划部主任Tomohiro Sudo表示:“我很高兴与ME Pharma就ME-401在全世界的开发和商业化扩大我们的协议。我们相信,ME-401有潜力为患者提供一个重要的新治疗选择,并进一步加强我们的全球管线。”
去年10月,MEI公司上公布了Ib期研究的更新数据。结果显示,接受ME-401治疗的所有患者组(FLL+CLL/SLL)的总缓解率(ORR)在75-100%,具体而言:(1)所有FL患者中ORR为78%(n=43/55)、ME-401单药治疗组ORR为79%、ME-401+利妥昔单抗联合治疗组ORR为75%。(2)所有CLL/SLL患者中ORR为89%(n=16/18)、ME-401单药治疗组ORR为100%、ME-401+利妥昔单抗联合治疗组ORR为71%。
该研究中,ME-401连续给药方案(CS)和间歇给药方案(IS)在FL和CLL/SLL患者中均表现出高缓解率和持久缓解,但IS方案组观察到的ME-401治疗相关3级不良事件的发生率比CS方案组较低。例如,3级腹泻/结肠炎发生率,IS方案组为5%,CS方案组为23%。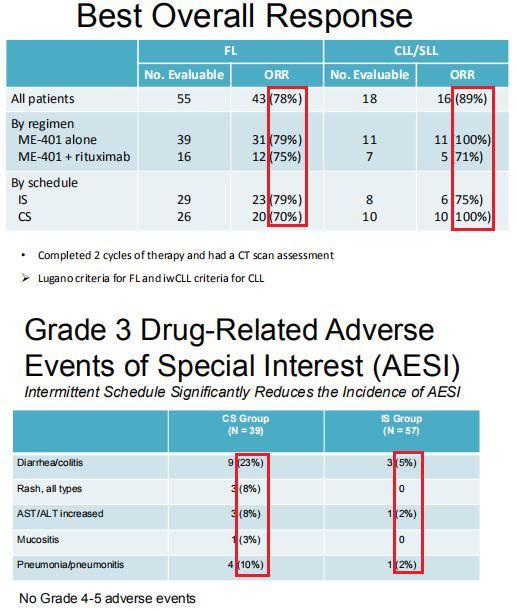
2018年11月,百济神州与MEI制药公司达成非独家临床合作,评估ME-401与Brukinsa联合治疗B细胞恶性的潜力。目前,ME-401+Brukinsa联合治疗方案已被纳入上述多臂、开放标签Ib期研究,评估治疗FL、MCL、DLBCL的潜力。
Brukinsa(泽布替尼,zanubrutinib)是百济神州的一款BTK抑制剂,于2019年11月获得美国FDA加速批准,用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者。特别值得一提的是,Brukinsa是首款由百济神州自主研发获批上市的产品,标志着该公司发展历程中的一个重大里程碑,同时也标志着第一款完全由中国企业自主研发、在美国批准上市的抗癌新药,实现中国原研新药出海“零的突破”。(100医药网100yiyao.com)
医药网新闻
- 相关报道
-
- CR:刷新认知!浙大团队首次发现,前列腺癌细胞竟能通过表达并分泌PD-1抑制抗肿瘤免疫 (2025-07-26)
- 罗氏2025H1:Phesgo增长55%,Polivy增长46%,中国区收入涨9% (2025-07-26)
- Cell子刊:CAR-T又攻克一种自身免疫病,成功治疗自身免疫性脑炎 (2025-07-26)
- Cancer Cell:中山大学徐瑞华团队发现,这种肠道细菌可增强癌症免疫治疗效果 (2025-07-26)
- Cell:新研究揭示运动通过促进肠道细菌产生甲酸,增强免疫疗法的抗癌疗效 (2025-07-25)
- Cell:新研究发现一类未知的RNA分子竟可促进外周神经再生 (2025-07-25)
- 血管里的“危险信号兵”!MedComm:颈动脉斑块小囊泡携特定微RNA揭示动脉硬化风险,助力精准判断斑块稳定性 (2025-07-25)
- Cell:肝脏通过全身信号反应驱动癌症恶病质 (2025-07-24)
- J Gen Physiol:蛋白cMyBP-C对维持心脏健康至关重要 (2025-07-24)
- 孔雀开屏:首都医科大学最新论文登上Cell子刊封面 (2025-07-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |
|


















