《科学》:癌细胞“自毁”DNA以求生存 |
 |
来源:奇点蛋糕2022-05-07 1:29
本研究发现并证实了肿瘤细胞在放疗后的一种独特的自救模式。
放射治疗是最广泛使用的基因毒性癌症疗法。辐射的能量可引起细胞内DNA损伤,包括DNA双链断裂(DSB)、单链断裂(SSB)和链间交联,从而阻断DNA复制和转录,导致细胞死亡[1]。
由于G1/S检查点关键调控因子p53的存在,正常细胞在DNA损伤后会停滞在G1期(DNA合成前期),不会进入S期(DNA合成期),启动DNA损伤修复机制。然而,在肿瘤细胞中,G1/S检查点调节因子往往无法发挥作用,这使得肿瘤细胞容易进入S期。因此,放疗引起的DNA损伤对肿瘤细胞来说是致命的毒药[2]。
然而,在临床上,许多肿瘤对放疗不敏感。因此,狡猾的肿瘤细胞必须进入DNA合成期(S)和有丝分裂期(M)之前(即G2期),找到保命的办法。
近日,丹麦哥本哈根大学Claus S. S rensen教授领导的团队在《科学》杂志上发表了重磅研究成果,帮助我们解开了谜团。
他们发现,在DNA受到辐射损伤后,肿瘤细胞会向DNA损伤位点募集一种核酸酶(CAD),在特定位点主动切断自身的DNA,并阻止复制和分裂,使肿瘤细胞停滞在G2期(DNA合成的后期),从而为修复放疗造成的DNA损伤赢得宝贵的时间[3]。
这一颠覆性的研究证实了肿瘤细胞在放射性DNA损伤的压力下具有自救方式,为提高放疗效果提供了新的思路和靶点。

报纸首页截图
其实十几年前就有科学家发现,接受放疗后,除了第一波DNA损伤外,细胞内还有第二波DNA损伤[4],而这一波延迟性DNA损伤的原因一直不是很清楚。
为了寻找放疗后DNA损伤诱导的G2/M检查点调控因子,研究人员通过高通量siRNA筛选了肿瘤细胞中已知的人类核酸酶文库。选择的第一个因子是RBBP8,一个已知的G2/M检查点因子。
出乎意料的是,第二个因素是CAD(CAD是一种参与细胞凋亡过程中DNA断裂的核酸酶,作为caspase信号级联的效应子),这是一种以前认为与DNA损伤反应或细胞周期检查点调控无关的因素。

高通量siRNA筛选肿瘤细胞中已知的人核酸酶文库
CAD的出现引起了Serensen及其同事的注意,他们推测核酸酶CAD可能是放疗后延迟DNA损伤背后的主谋,它可以通过某种机制充当DNA损伤诱导的G2/M检查点调节因子。
为了验证这一点,研究人员对野生型和CAD-KO人类细胞HCT116进行辐射,发现在辐射后的早期(10min-6h),野生型和CAD-KO细胞的DNA损伤是相似的,但在24小时后,野生型细胞的DNA损伤远远高于CAD-KO细胞。这表明放疗后迟发性DNA损伤可能是由CAD介导的。
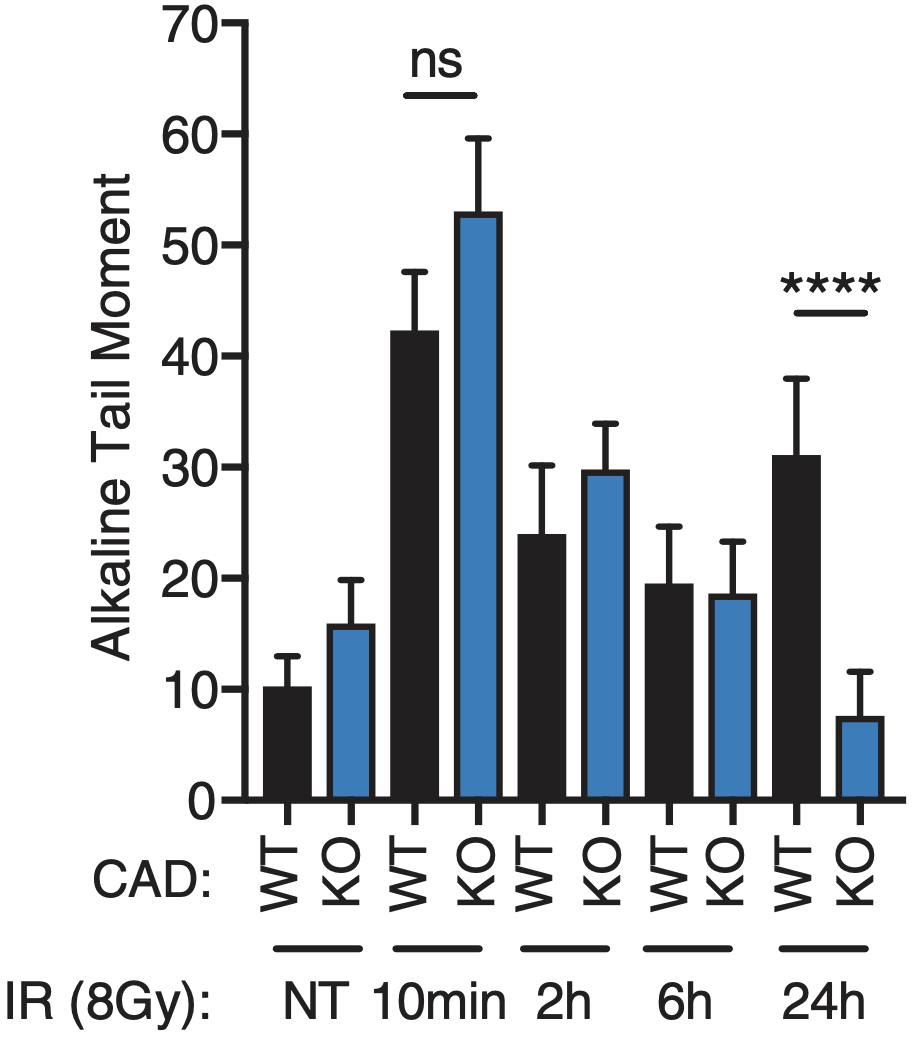
照射24小时后,野生型细胞的DNA损伤远远高于CAD-KO细胞。
研究表明,细胞中CAD的激活通常由caspase-3介导,caspase-3将CAD与ICAD(CAD抑制蛋白)分离,使CAD二聚化,然后切割DNA。
然而,研究人员没有观察到放疗后胱天蛋白酶-3激活和ICAD蛋白水解的证据。此外,泛素-半胱天冬酶抑制剂不能抑制延迟的DNA损伤。这表明放疗后CAD的激活方式不是依赖于caspase-3的经典方式。
S . rensen的团队通过研究发现,CAD和ICAD都是在DNA损伤反应的介导下被募集到DNA断裂的区域。然而,ATM和ATR激酶(介导DNA损伤反应)的抑制或缺失可以限制CAD/ICAD的募集,并减少DNA断裂。
通过蛋白质序列分析,研究人员发现ICAD上有两个高度保守的位点(Ser107和Ser257)可以被ATM/ATR磷酸化。通过设计针对Ser107和Ser257的ICAD磷酸化特异性抗体,验证了这两个位点在细胞受到辐射后被广泛磷酸化,磷酸化程度依赖于ATM和ATR激酶的活性。
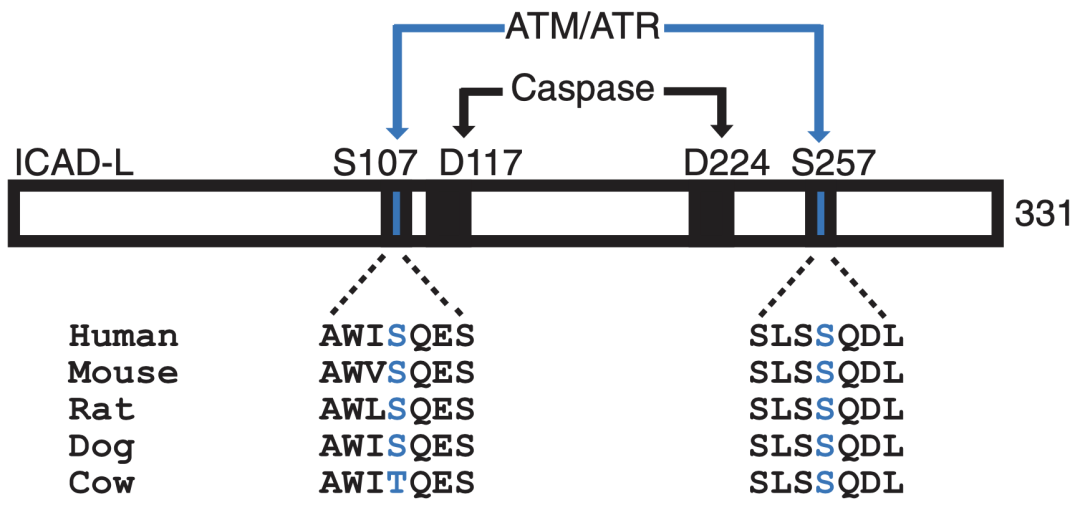
ICAD上有两个高度保守的位点(Ser107和Ser257)可以被ATM/ATR磷酸化。
然后,研究人员设计了相应位点不能磷酸化的ICAD丝氨酸-丙氨酸突变细胞(S107A和S257A)来研究ICAD的磷酸化功能。突变细胞经放射性照射后,突变ICAD不能稳定地募集到DNA损伤区。
上述结果表明,ICAD的ATR/ATM依赖性磷酸化是CAD/ICAD募集到DNA损伤区域的关键。
但问题是,当CAD与ICAD结合后,其功能受到抑制。怎么会导致DNA断裂?
事实证明,当CAD与ICAD结合时,发挥DNA酶作用的结构域仍然暴露在外。正常情况下,CAD/ICAD二聚体不会聚集在DNA区域,但当受到辐射时,DNA损伤反应磷酸化ICAD,将CAD/ICAD招募到DNA损伤区域,并介导DNA断裂。
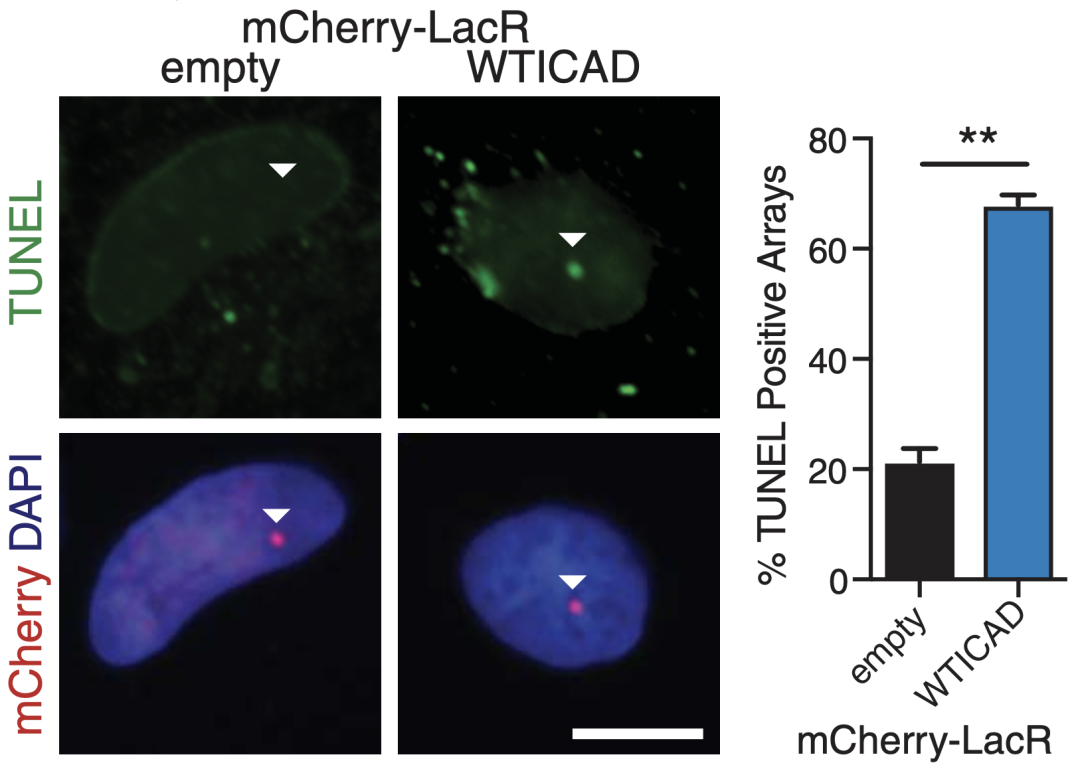
DNA损伤后,CAD/ICAD被募集到损伤的DNA区域,介导DNA断裂。
Claus S. S rensen教授团队通过进一步研究发现,CAD介导的DNA断裂是在特定位点(染色质修饰的CCCTC结合因子位点附近)进行的,而不是随机分布在基因组中。这也从侧面反映出这种自发的DNA断裂是肿瘤细胞有预谋的。
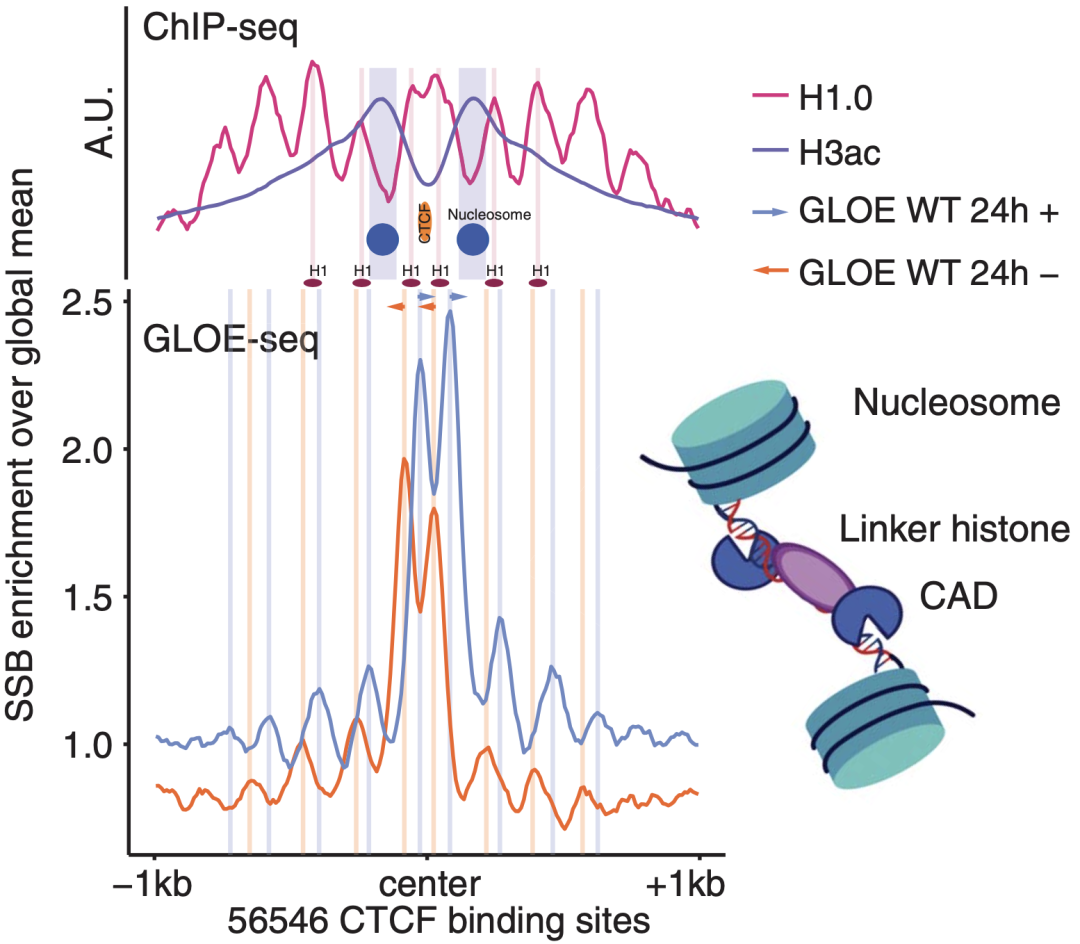
受损DNA位于特定位点(靠近染色质修饰的CCCTC结合因子位点)
然后,研究人员探索了CAD如何使肿瘤细胞停滞在G2期而不是M期。他们发现,CAD介导的DNA片段化后,细胞周期蛋白依赖性蛋白激酶CDK1的抑制性磷酸化(Tyr15)下降,激活的检查点因子CHK2下降,导致细胞停滞在G2期。
而CAD对正常细胞的G2/M期无明显影响,因为正常细胞具有正常的p53和pRB通路,即完善的G1/S检查点,从而减少了对G2/M检查点的依赖。
最后,研究人员通过使用人类肿瘤异种移植小鼠模型,在体内评估了CAD在放疗中的功能。与细胞中的研究一致,与CAD野生型肿瘤相比,CAD功能障碍性肿瘤对放疗更敏感。
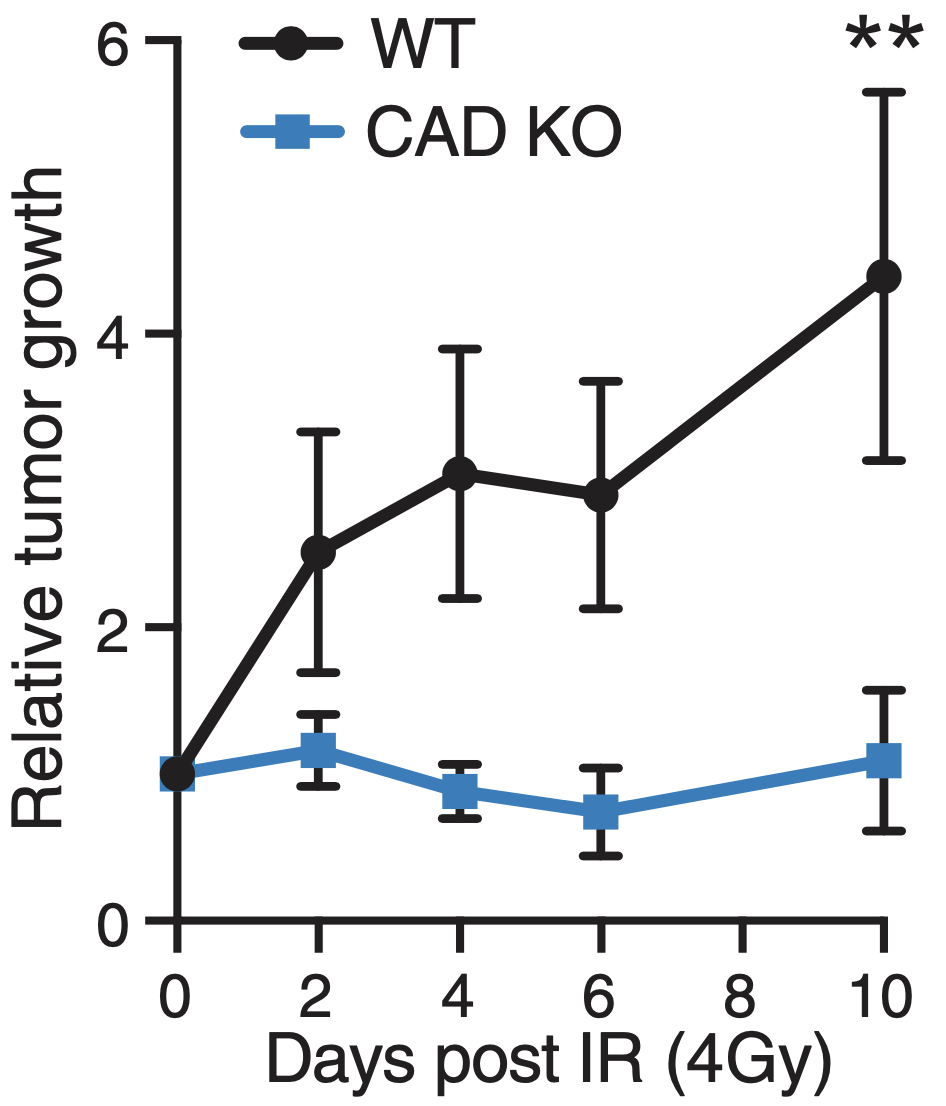
与CAD野生型肿瘤相比,CAD功能缺陷型肿瘤对放疗更敏感。
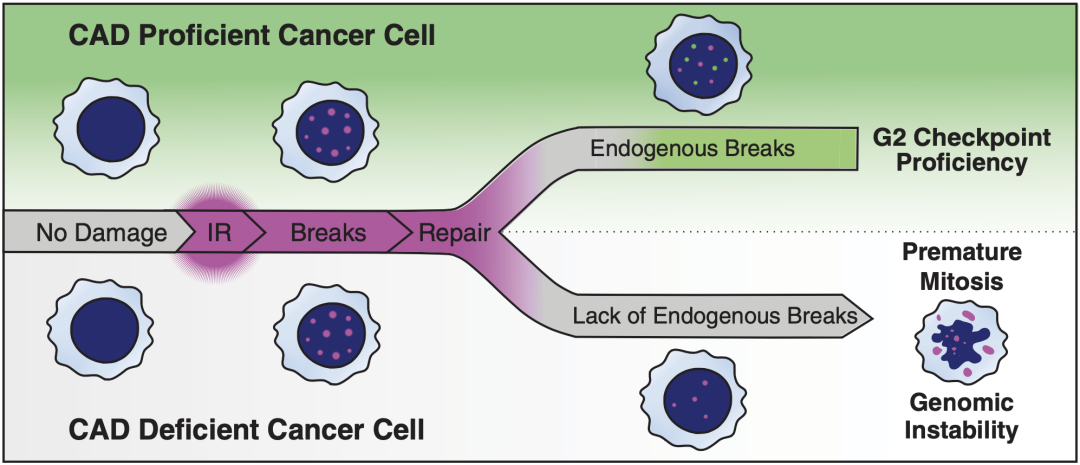
总的来说,本研究发现并证实了肿瘤细胞在放疗后的一种独特的自救模式。放疗引起DNA损伤后,肿瘤细胞中的CAD/ICAD在DNA损伤反应的介导下被募集到DNA损伤区,导致基因组中特定位点的DNA断裂。
机构示意图
虽然DNA断裂通常对细胞来说是个坏消息,但肿瘤细胞可能正在自行制造一些简单易修复的DNA损伤,使分裂旺盛的肿瘤细胞停滞在G2期,从而获得足够的时间修复放疗造成的DNA损伤。可能这就是所谓的大局吧。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- 【9月23日直播预告】非靶代谢流线上分享会——解码代谢动态,探寻疾病机制 (2025-09-19)
- 【参会指南】9月26-27日,2025(第九届)细胞外囊泡前沿与转化大会(厦门站)即将开幕! (2025-09-18)
- 西湖大学最新Cell子刊论文:利用孕妇肠道菌群预测早产风险 (2025-09-17)
- Cell:高分子量tau蛋白抑制海马体神经元活动,导致阿尔茨海默病的认知衰退 (2025-09-17)
- 两篇《自然》:肺癌私联神经元!科学家首次发现小细胞肺癌细胞会在脑内与神经元形成突触,借助电信号促进肿瘤生长 (2025-09-16)
- Sci Adv:新型双特异性抗体有望成为抗击巨细胞病毒的“免疫特种兵” (2025-09-16)
- 《神经病学》:代糖或伤认知!8年随访发现,摄入较多代糖与记忆力、语言流畅性和整体认知能力下降速度提升32%、173%和62%相关 (2025-09-16)
- Nature子刊:超越ADC,中国博后发明ABC药物,重拳出击,精准靶向 (2025-09-16)
- Cell子刊:“滴血验癌”新突破,王延博/张硕等利用细胞外囊泡,精准检测10多种癌症 (2025-09-16)
- 47亿!派林生物易主中国生物,血液制品行业格局将重塑 (2025-09-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















