Molecular Cell:研究揭示MLL家族蛋白具有不同产物特异性的分子机制 |
 |
来源:互联网2022-09-27 1:39
揭示了具有不同产物特异性的MLL家族成员的结构基础和分子机制。
赖氨酸甲基转移酶催化底物甲基化是一个经典的多步催化反应。赖氨酸可以添加一个、两个或三个甲基。同一位点不同程度的甲基化一般被视为不同的化学修饰标记,发挥不同的生物学功能。最典型的例子是组蛋白H3K4的单甲基化、二甲基化和三甲基化。在哺乳动物中,H3K4 (H3K4me3)的三甲基化通常分布在转录起始位点(TSS)附近,与转录激活密切相关。H3K4 (H3K4me1)的单甲基化通常位于增强子区,是增强子的典型标志。
为什么H3K4不同程度的甲基化会有不同的基因组分布?一般认为它与甲基转移酶的基因组定位及其催化不同甲基化产物产生的酶活性特征(产物特异性)密切相关。体内H3K4甲基化主要由MLL家族甲基转移酶催化。在哺乳动物中,有六个MLL家族蛋白成员具有甲基转移酶活性,包括MLL1、MLL2、MLL3、MLL4、SET1A和SET1B。尽管它们都来源于酵母中相同的祖先Set1,但不同的MLL家族蛋白在细胞命运决定中起着重要且非冗余的作用。在过去,大量的体内和体外研究表明,不同的MLL家族成员具有不同的产物特异性,即它们产生单-、二-和三甲基产物的能力是不同的。然而,对于如何准确定义不同MLL蛋白的产品特异性,仍然缺乏一个可靠的判断标准。
早在2003年,就有研究者提出了F/Y开关模型来解释甲基转移酶的产物特异性。根据该模型,SET催化结构域活性口袋中的一个关键氨基酸残基决定了甲基转移酶的产物特异性。带有酪氨酸(Y)残基的甲基转移酶只能催化单甲基化,而带有苯丙氨酸(F)残基的甲基转移酶可以催化双甲基化或三甲基化。然而,目前的F/Y转换规则仍然无法区分二甲基转移酶和三甲基转移酶,无法解释MLL家族的不同产物特异性。MLL家族蛋白的活性口袋具有相同的F/Y开关残基,但表现出不同的产物特异性。其背后的分子机制一直是该领域未解决的问题。
中国科学院分子细胞科学卓越与创新中心陈勇团队、华东理工大学全树团队、大连化物所李国辉团队、中国蛋白质科学中心刘志军和彭超团队在《分子细胞》杂志上发表了题为《MLL家族甲基转移酶产品特异性城市的结构基础》的研究论文,揭示了具有不同产品特异性的MLL家族成员的结构基础和分子机制。

在这项研究中,研究小组系统地比较了MLL家族复合体的产品特异性。他们发现所有的MLL配合物都能在短时间内使未修饰的H3单甲基化。大多数MLL配合物可以继续进一步甲基化单甲基化的H3产生二甲基产物,而MLL1,MLL2,SET1A,SET1B配合物随着时间的推移可以进一步产生三甲基产物。这些现象表明,仅通过检测特定时间节点上单、二和三甲基甲基化产物的形成来定义甲基转移酶的产物特异性是不准确的。观察到的产物形成与酶浓度、酶活性、产物特异性等因素有关,需要综合考虑各级甲基化的反应速率来定义MLL的产物特异性。
此外,研究小组建立了三种定量方法,甲基量子WB、甲基量子LC MS/MS和甲基量子MALDI-TOF MS,以表征MLL配合物催化的单、二和三甲基化反应的动力学差异。通过测量不同MLL配合物催化底物的单甲基化、二甲基化和三甲基化的速率常数k1、k2、k3,并比较反应速率之间的差异,研究人员将MLL1/MLL2定义为不连续二甲基转移酶,将MLL3/MLL4定义为单甲基转移酶,将SET1A/SET1B定义为不连续三甲基转移酶。使用这些检测系统,研究人员进一步发现,产物特异性主要由最小的MLL-RBBP5-ASH2L三元复合物决定,其他亚基如DPY30主要影响酶活性速率,但不影响产物特异性。
为了进一步探索产物特异性的分子机制,通过X射线晶体学、19F-NMR和分子动力学计算模拟了MLL家族蛋白活性口袋中F/Y开关的两个关键酪氨酸残基的空间构象和动力学。他们发现不同MLL家族蛋白质中关键酪氨酸残基的构象基本相同,但表现出不同的动力学。对于第一个关键酪氨酸残基(Y1),动态集1b & gt;MLL1 & gtMLL3,所以SET1B和MLL1可以克服Y1的空间位阻,有利于H3K4me1到H3K4me2的过程,而Y1在MLL3的相对固定不利于二甲基反应。对于第二个关键酪氨酸残基(Y2),动态集1b & gt;MLL1,所以SET1B更容易克服Y2的空间位阻,有利于催化生成H3K4me3。这种分子机制也可以扩展到其他甲基转移酶。例如,F/Y开关的动力学可用于区分二甲基转移酶GLP和三甲基转移酶DIM5。
综上所述,本工作提出了级联反应中不同步骤之间的速率比(k1/k2和k2/k3)不是绝对反比。
应速率,是定义组蛋白甲基转移酶产物特异性的定量标准。这项工作揭示了关键氨基酸的动态性在甲基转移酶催化进程中的重要作用,为进一步了解组蛋白甲基化的动态调控机制奠定了基础。根据这个工作,人们将来可以通过点突变改变组蛋白甲基转移酶的产物特异性,用以阐明不同状态的甲基化修饰在各种生命活动中的重要功能。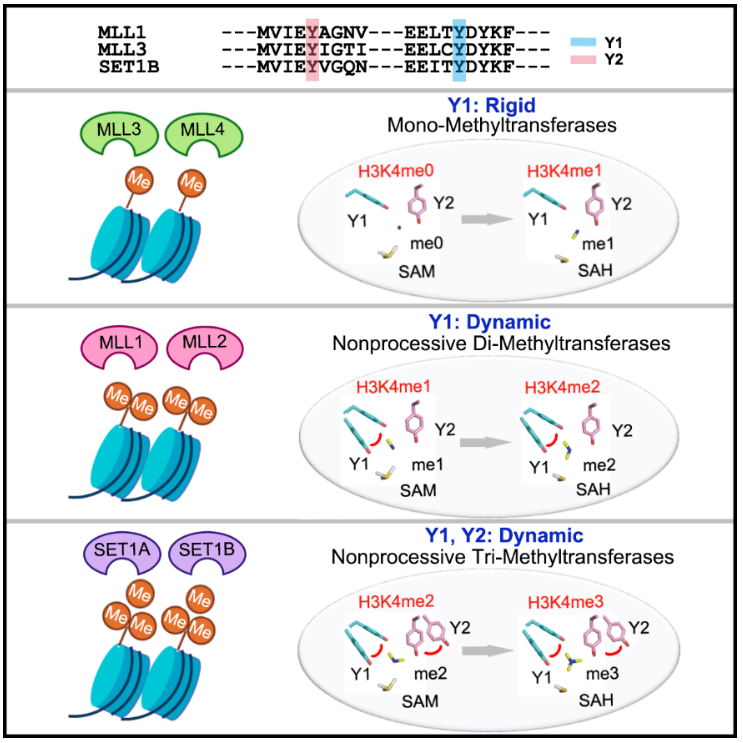
 医药网新闻
医药网新闻

- 相关报道
-
- Cancer Cell:肿瘤内细菌,驱动癌症治疗耐药性 (2025-10-19)
- 哈医大最新研究登上Cell头条:从多组学视角揭示不同器官系统的衰老差异 (2025-10-18)
- Nature Biotechnology:FUGAsseM利器出鞘——一种基于微生物群落共表达的功能预测新范式 (2025-10-18)
- Cell:西湖大学卢培龙团队等首次从头设计出电压门控离子通道,在体内抑制神经元电活动 (2025-10-18)
- Cell子刊:毕楠/崔明/葛红等人揭示肠道菌群可预测肺癌巩固免疫治疗效果及放化疗毒性 (2025-10-17)
- Neuron:高郑润/徐天乐/吴逸雯等揭示中风后情绪障碍的新机制 (2025-10-17)
- Nature系列综述:西湖大学董晨院士系统总结CD8⁺T耗竭的调控因子 (2025-10-16)
- 由趋势观前沿:毕马威正式发布第三届生物科创领航50企业报告 (2025-10-15)
- 从“假基因”到“致病元凶”!Brain新研究:SSPOP基因复合杂合突变诱发儿童癫痫,多模型证实其功能与致病机制 (2025-10-15)
- Science:“吃不胖”的免疫学新解——T细胞胆固醇稳态是决定膳食脂肪吸收的关键 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















