因生产问题,FDA推迟批准外用基因疗法B |
 |
来源:医药魔方 2023-01-13 17:51
B-VEC是一种基于单纯疱疹病毒1型(HSV-1)的局部外用基因疗法,旨在通过直接应用于伤口递送COL7A1基因来恢复正常COL7蛋白的表达。Krystal Biotech宣布,在收到其于2022年12月20日提交的制造信息文件后,决定将B-VEC用于治疗营养不良性大疱性表皮松解症的生物制品许可申请(BLA)的PDUFA日期推迟至2023年5月19日,并建议说明书标签讨论不迟于2023年4月20日。
Krystal Biotech提交的制造信息文件包括有关制造过程的浓缩步骤中更换的硬件元件(不影响加工参数或产品接触材料)的附加信息以及支持证明该元件可用的可比性数据。
在2022年12月15日举行的BLA后期周期审查会议上,FDA表示不会召开B-VEC的咨询委员会会议,且B-VEC的BLA不需要提供风险评估和缓解策略(REMS,要求某些存在严重安全问题的药物提供的一项药品安全计划,以帮助确保药品的获益大于风险)。
营养不良性大疱性表皮松解症(DEB)是一种罕见且严重的单基因遗传性皮肤病,由负责编码VII型蛋白质胶原蛋白(COL7)的COL7A1基因发生一个或多个突变引起。这种突变会导致皮肤缺少将真皮(皮肤内层)与表皮(皮肤外层)固定在一起的基底膜结构,使得患者的皮肤和粘膜组织极度脆弱,轻微摩擦或创伤都会引起水疱和撕裂。DEB患者的伤口通常无法完全愈合,进一步导致皮肤感染和纤维化,后者可能使手指和脚趾融合,并最终增加发展为侵袭性鳞状细胞癌的风险,严重时可能致命。目前全球尚无针对性疗法获批。
B-VEC是一种基于单纯疱疹病毒1型(HSV-1)的局部外用基因疗法,旨在通过直接应用于伤口递送COL7A1基因来恢复正常COL7蛋白的表达。
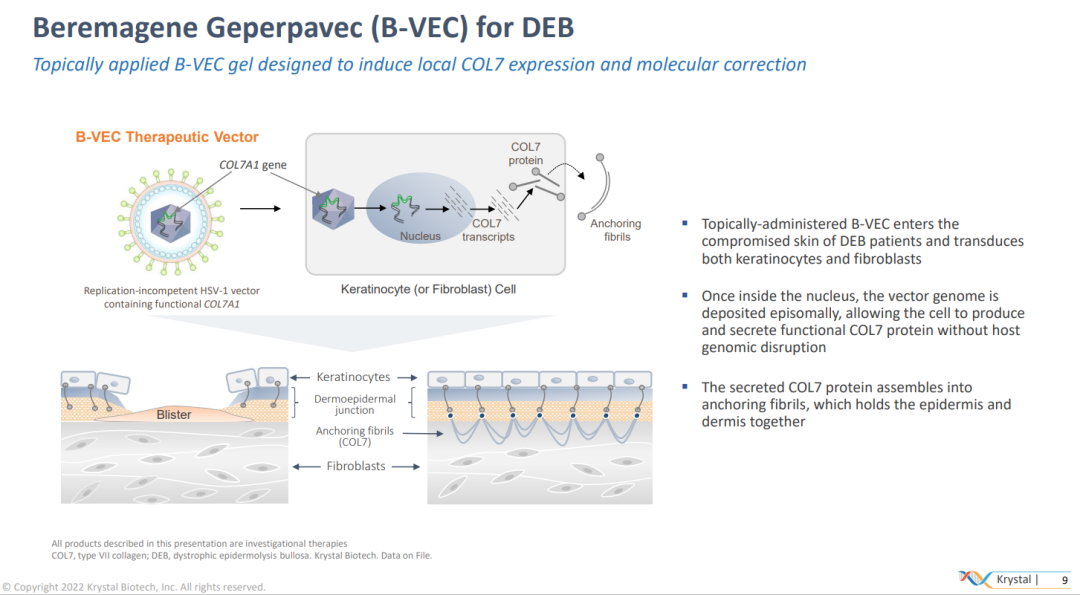
B-CEC的作用机制(来源:Krystal Biotech官网)
Krystal Biotech董事长兼首席执行官Krish S. Krishnan说: 虽然我们对这一信息变动被视为一项重大修正感到失望,但我们一直在努力与FDA合作,因为它完成了对B-VEC的BLA的审查。我们将继续进行商业化准备工作,并争取在B-VEC获得批准后尽快为DEB患者提供药物。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















