《自然·癌症》:发现抗CTLA |
 |
检查点阻断(ICB)给癌症治疗带来了新的希望。其中,CTLA-4是经典的免疫检查点,它可以通过抑制CD80或CD86与共刺激受体CD28的结合来抑制T细胞活性[1]。靶向CTLA-4的单克隆抗体广泛应用于临床治疗,但可惜的是,只有小部分病人能从中获益[2]。
抗CTLA-4抗体的Fc端与Fc受体(Fc Rs)结合诱导的抗肿瘤作用是近年来的研究热点。有研究表明,抗CTLA-4抗体不仅可以激活细胞毒性T细胞,还可以通过结合Fc Rs促进肿瘤浸润调节性T细胞(Treg)耗竭[3-4]。不过有关于Fc R结合对抗CTLA-4抗体驱动的抗肿瘤活力的贡献仍存在很大的争议。
近日,以色列雷霍沃特的魏茨曼科学研究所的Sergio A. Quezada教授和伦敦大学学院癌症研究所的Ido Amit 教授强强联合揭开了这一谜题,该成果发表在著名期刊Nature Cancer上。
研究团队利用大量的单细胞测序(sc-RNAseq)揭示了,具有较强Fc R结合能力的抗CTLA-4抗体可以抑制肿瘤生长和驱动免疫重塑,这不仅是由Treg耗竭和CTLA-4阻断导致的,而且是由Fc R结合和I 型干扰素导致的。

接下来就让我们看看这项研究是如何展开的。
首先,在MCA-205(纤维肉瘤)和MC38()的荷瘤小鼠中,研究团队分别给予它们CTLA-4 mIgG1(CTLA-4 m1)抗体和CTLA-4 mIgG2a(CTLA-4 m2a)抗体治疗。与CTLA-4 m1抗体相比,CTLA-4 m2a抗体具有更强的Fc R结合能力。实验结果表明,与对照组(未治疗组)和CTLA-4 m1抗体相比,CTLA-4 m2a抗体可以显著抑制MCA-205和MC38肿瘤的生长。
那么CTLA-4 m2a抗体是如何影响肿瘤微环境(TME)的呢?
研究团队利用scRNA-seq分析了治疗第8天的小鼠MCA-205肿瘤的免疫细胞组成。Ido团队通过无监督细胞聚类分析鉴定了不同的免疫细胞亚群,其中包括Treg、免疫抑制性髓系细胞(Arg+肿瘤相关巨噬细胞(TAM)、Arg+单核细胞)、表达IFN信号通路相关基因的炎症性髓系细胞(Ifit1+TAM、Ifit1+单核细胞)等。
分析结果还显示,CTLA-4 m1抗体治疗组的肿瘤浸润免疫细胞组成与对照组相似,而CTLA-4 m2a抗体治疗驱动了多种免疫细胞亚群的重塑。在淋巴细胞组成中,高表达ctla4的Treg细胞被耗竭了。除此之外,髓系细胞组成也发生了显著变化,单核细胞/TAM比例增加、Arg+单核细胞/Ifit1+单核细胞、Arg+TAM/Ifit1+TAM比例增加以及中性粒细胞比例增加等。
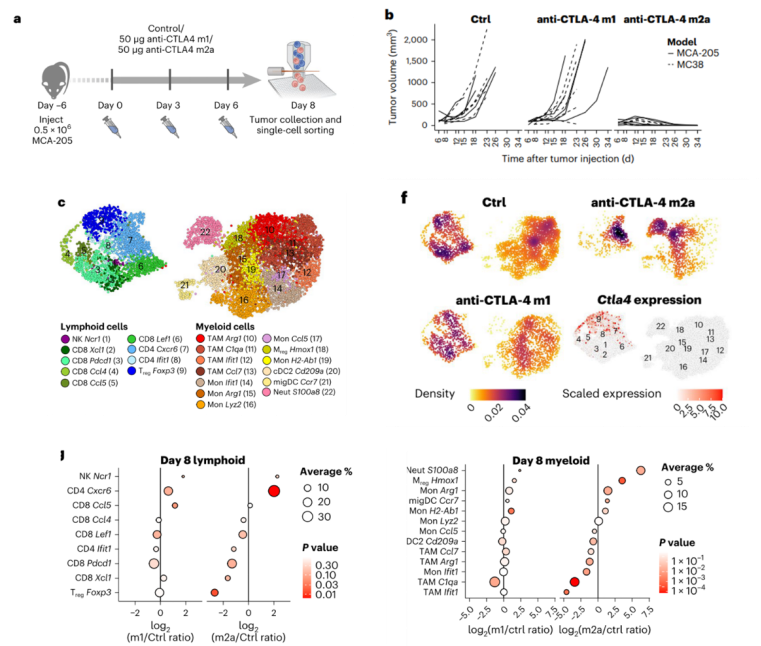
CTLA-4 m2a抗体可以抑制肿瘤生长和驱动免疫重塑
但是,这些免疫重塑包含了抗CTLA-4抗体对TME的直接和间接作用。为了更好地研究抗CTLA-4抗体的直接作用,Ido团队利用scRNA-seq分析了治疗第1天的小鼠MCA-205肿瘤的免疫细胞组成。
令人惊喜的是,在治疗第1天,抗CTLA-4 m2a抗体也可以同时驱动淋巴细胞和髓系细胞的免疫重塑。但这与第八天略有不同,主要表现中性粒细胞的比例没有显著变化,而炎症性单核细胞/免疫抑制性单核细胞、炎症性TAM/免疫抑制性TAM比例增加。除此之外,基因集富集分析(GSEA)的结果表明,在抗CTLA-4 m2a抗体治疗组中,IFN信号通路相关的基因在髓系细胞上高表达。而抗CTLA-4 m1抗体对小鼠TME没有显著影响。
上述数据表明, 抗CTLA-4 m2a抗体通过诱导Treg细胞耗竭和髓系细胞重编程促使TME向促炎和活化的状态转换。
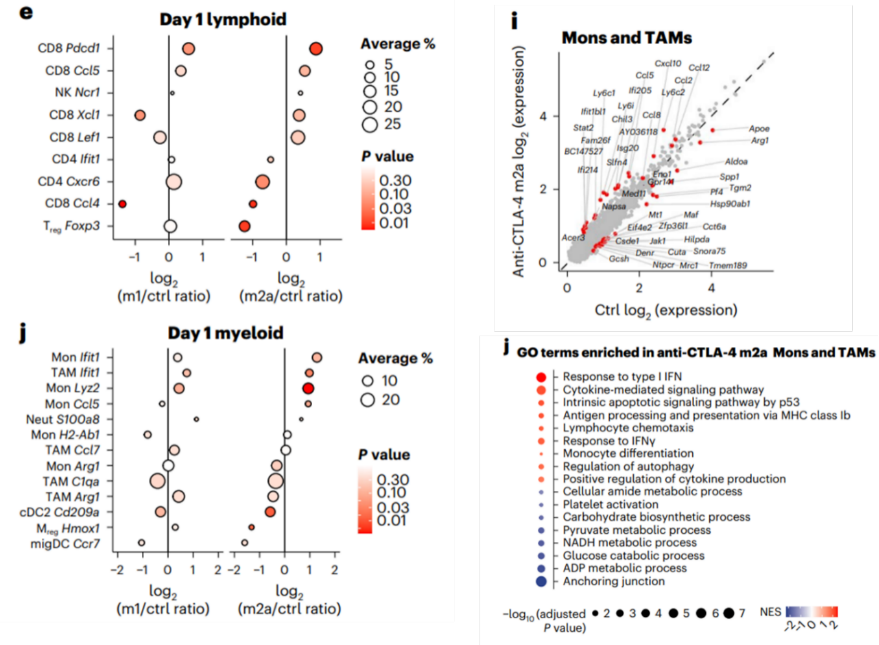
CTLA-4 m2a抗体可以驱动快速的免疫重塑
研究人员推测,Fc R可能在抗CTLA-4 m2a抗体驱动的免疫重塑中起到了重要作用。因此,他们使用了转基因小鼠进一步研究了Fc R的作用机制。在Foxp3DTR小鼠中,他们利用白喉毒素(DT)诱导了MCA205肿瘤浸润Treg细胞耗竭。与抗CTLA-4 m2a抗体相比,白喉毒素虽然能诱导Treg细胞耗竭,但不能抑制MCA205肿瘤生长,也不能驱动髓系细胞重编程。差异基因表达(DEG)的分析结果表明,与抗CTLA-4 m2a抗体治疗组相比,DT治疗组中差异表达的基因非常少,并且都与I型IFN信号通路无关。此外,如果敲除小鼠的Fc R基因(FcgrKO小鼠),抗CTLA-4 m2a抗体也不能抑制其肿瘤生长和驱动髓系细胞重编程。
也就是说,在抗CTLA-4 m2a抗体治疗后,Fc R结合在驱动髓系细胞重编程和I型IFN信号通路中起到了重要作用。
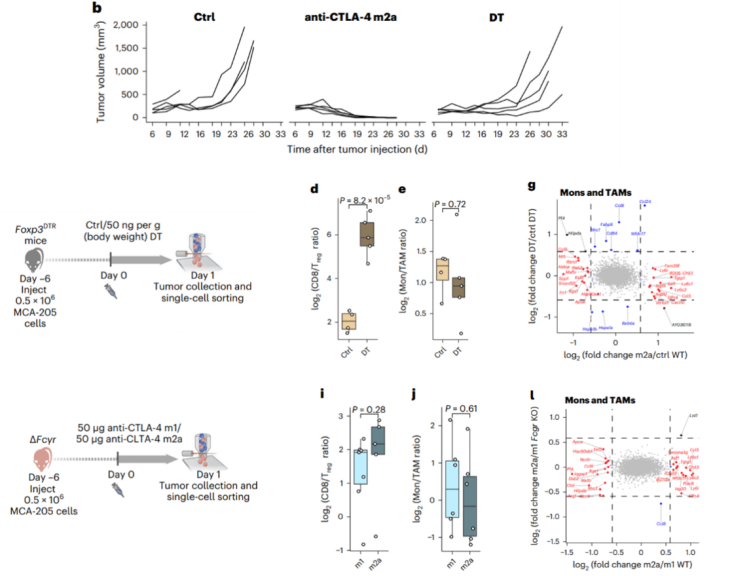
Fc R结合在CTLA-4 m2a抗体驱动的髓系细胞重编程中起到了重要作用
为了单独研究在抗CTLA-4 m2a抗体治疗后Fc R对髓系细胞重编程的影响,研究人员进行了一系列体外实验,首先,他们将小鼠脾脏的Treg细胞与骨髓来源的巨噬细胞(BMDM)进行共培养。BMDM分别来自野生型(WT)、FcgrKO和IFN 受体(Ifnar) KO小鼠。此外,他们还将Treg细胞和BMDM与抗CTLA-4 m1抗体、抗CTLA-4 m2a抗体和对照的培养基分别进行共培养,并对分选出的BMDM进行scRNA-seq。
研究发现,体外培养实验的结果与小鼠体内实验的结果一致。在野生型小鼠中,与对照和抗CTLA-4 m1抗体治疗组相比,在抗CTLA-4 m2a抗体治疗组中,虽然Treg细胞没有耗竭,但髓系细胞还是发生了重编程。例如炎症性BMDM/免疫抑制性BMDM细胞的比例增加,IFN信号通路相关的基因(Isg20、Irf7和Ifit1)表达上调。这表明Fc R驱动的髓系细胞重编程与Treg细胞耗竭互相独立。
此外,与野生型小鼠相比,FcgrKO和IfnarKO小鼠中IFN信号通路相关的基因表达下调,并且抗CTLA-4 m2a抗体也不能抑制IfnarKO小鼠肿瘤的生长。
上述结果表明,髓系细胞Fc R的结合和I型IFN信号对于抗CTLA-4 m2a抗体的抗反应至关重要。
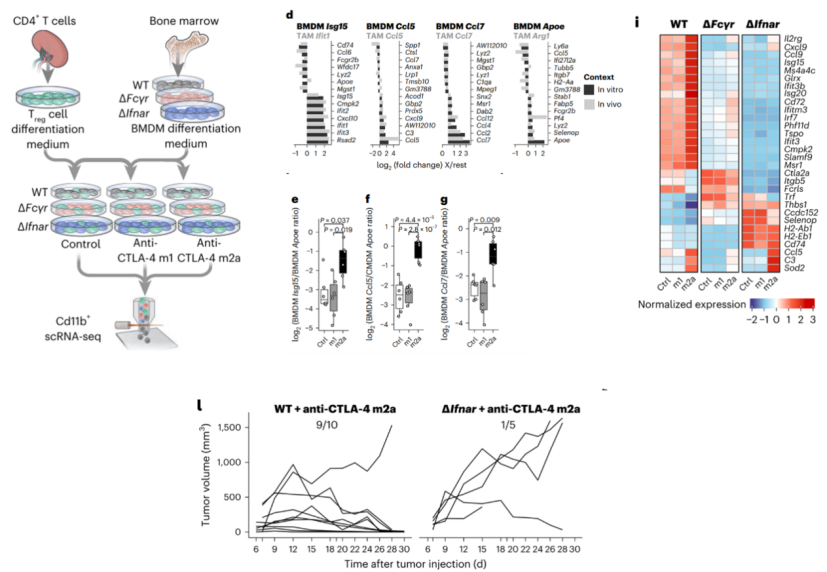
髓系细胞Fc R的结合和I型IFN信号在CTLA-4 m2a抗体的抗肿瘤免疫反应中起到了重要作用
总的来说,该项研究通过大量的单细胞测序和小鼠实验揭示了Fc R结合是抗CTLA-4抗体的抗肿瘤新机制,并且展现了开发具有更强Fc R结合能力的抗CTLA-4抗体的巨大前景。
不过本篇文章还停留在临床前研究的阶段。新的抗CTLA-4抗体的开发和应用仍旧任重而道远。在未来,就让我们期待进一步的临床试验探索新的抗CTLA-4抗体的效果,为众多的癌症患者带来新的希望。
此外,举一反三,Fc R结合与其他免疫治疗的联合是否也有更强的抗肿瘤能力也值得期待!
参考文献:
[1]Walker LS, Sansom DM. Confusing signals: recent progress in CTLA-4 biology. Trends Immunol. 2015;36(2):63-70. doi:10.1016/j.it.2014.12.001
[2]Weiss SA, Wolchok JD, Sznol M. Immunotherapy of Melanoma: Facts and Hopes. Clin Cancer Res. 2019;25(17):5191-5201. doi:10.1158/1078-0432.CCR-18-1550
[3]Simpson TR, Li F, Montalvo-Ortiz W, et al. Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma. J Exp Med. 2013;210(9):1695-1710. doi:10.1084/jem.20130579
[4]Arce Vargas F, Furness AJS, Litchfield K, et al. Fc Effector Function Contributes to the Activity of Human Anti-CTLA-4 Antibodies. Cancer Cell. 2018;33(4):649-663.e4. doi:10.1016/j.ccell.2018.02.010
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















