TN:治疗三个月认知改善29%!轻中度阿尔茨海默病患者有望迎来新疗法 |
 |
来源:奇点糕 2023-02-16 17:18
本临床试验证明了CMA对于改善轻中度AD患者的认知功能具有一定作用,且这一保护作用在基线认知功能较差的患者中更为明显。越来越多的研究表明,阿尔茨海默病(AD)与系统性代谢异常相关,代谢异常导致的线粒体功能障碍和能量代谢紊乱可导致认知功能受损,对AD的发病起到 推波助澜 的作用[1, 2]。
那么通过药物来改善机体代谢状态,是否能起到减缓认知衰退的进程呢?
近日,来自瑞典皇家理工学院Mathias Uhl n和Adil Mardinoglu团队,在《转化神经变性病》(TranslationalNeurodegeneration,TN)杂志发表了一项随机、安慰剂对照的2期临床试验结果,探究了复方代谢激活剂(CMA)对于AD患者整体认知功能和代谢的影响[3]。
临床试验结果表明,AD患者服用CMA后第84天的ADAS-Cog(得分越低代表认知功能越好)得分较服药前显著降低(P=0.00001,改善29%),而且在服药前ADAS-Cog得分较高(症状较重)的AD患者中,CMA的效果越明显(P=0.0073)。此外,CMA治疗后AD患者血浆中与NAD+和谷胱甘肽等与能量代谢和抗氧化损伤相关的蛋白质和代谢物水平显著升高。
这些结果表明,CMA治疗可以改善AD患者代谢状态和认知功能,为AD的治疗提供了新方向。

论文首页截图
这项随机、安慰剂对照的2期临床研究(NCT04044131)纳入的受试者为年龄大于50岁的轻中度AD患者,ADAS-Cog得分 12,临床痴呆评定量表-总分(CDR-SOB) 2,有脑病史、严重脑外伤病史和毒物暴露史的患者被排除在外。
患者被随机分配接受CMA或安慰剂(2:1)治疗,所有受试者在试验前28天每天晚餐后服用一剂药物,并在第28天后到第84天分别在早餐和晚餐后服用两剂药物。
每剂CMA含有12.35克L-丝氨酸(61.75%)、1克烟酰胺核糖(NR,5%)、2.55克N-乙酰半胱氨酸(NAC,12.75%)和3.73克L-肉碱酒石酸盐(LCAT,18.65%)。这些药物对于维持线粒体功能、细胞能量稳态、抗炎和抗氧化损伤起到重要作用,且均被报道在AD患者中存在异常减少[4-6]。
研究的主要终点为评估CMA在AD患者中的临床疗效,通过ADAS-Cog、AD日常能力量表(ADCS-ADL)和简易精神状态检查量表(MMSE)比较安慰剂组和CMA组治疗前后的认知功能和日常生活活动能力。研究的次要终点为评价CMA的安全性和耐受性,同时对服用CMA后机体代谢状态的改变进行了探索。
在2020年2月1日至10月1日期间,共有69名轻至中度AD患者被纳入该研究,其中47名患者被分配到CMA组,22名患者被分配到安慰剂组。9名患者(CMA组7名,安慰剂组2名)在第84天的随访前因而退出研究。
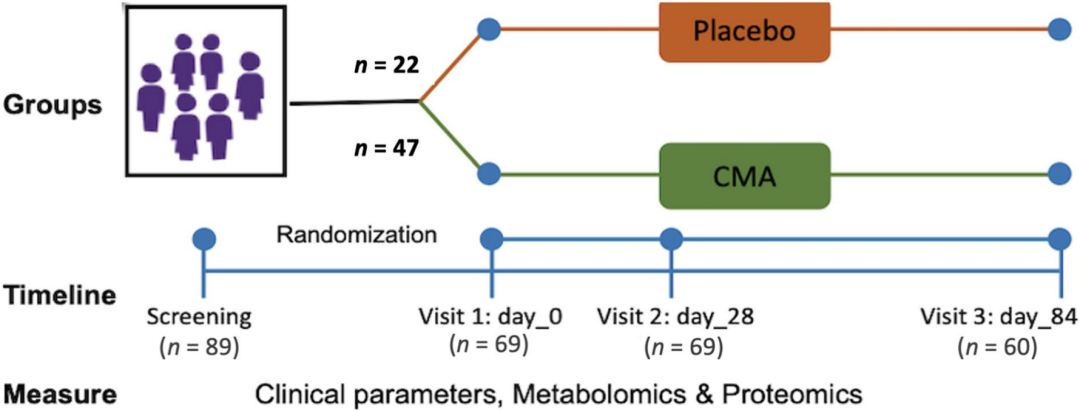
研究流程图
受试者的平均年龄为70.8岁,其中52.1%为男性,CMA组平均ADAS-Cog得分为22.88 10.51,安慰剂组为26.28 17.35,两组间的人口学参数和基线AD临床指标没有显著差异。
研究人员首先分析了两组受试者神经认知功能的变化。在CMA组中,受试者在治疗后第28天(P<0.001,改善26%)和第84天(P<0.001,改善29%)的ADAS-Cog得分较基线显著降低。同时,安慰剂组受试者在第28天(P=0.009,改善12%)和第84天(P=0.001,改善14%)的ADAS-Cog得分较基线同样显著降低,但降低的幅度没有CMA组大。CMA组和安慰剂组在第28天和第84天的ADAS-Cog得分无明显区别。
对于其他指标 ADCS-ADL和MMSE,任何时间点或组之间没有发现ADCS-ADL得分存在显著差异,安慰剂组MMSE得分在第28天和第84天较基线存在明显差异,而CMA组MMSE得分仅在第28天显著高于基线得分。
研究人员猜想,这一结果可能与安慰剂效应有关。据相关研究报道,安慰剂效应在AD临床试验的早期阶段很明显,甚至可能持续长达12个月[7]。
紧接着,研究人员将受试者按基线时的ADAS-Cog得分分为低得分组(评分 20分,n=39)和高得分组(评分 20分,n=30)。在高得分组中,CMA组和安慰剂组之间在第84天的ADAS-Cog得分存在显著差异(P=0.0073),且CMA组在第28天(P=0.002,改善24%)和第84天(P=0.003,改善30%)时的ADAS-Cog得分较基线时显著降低,而安慰剂组在这两个时间点与基线时得分无差异。这表明ADAS-Cog评分高(症状较重)的AD患者对CMA治疗更为敏感。
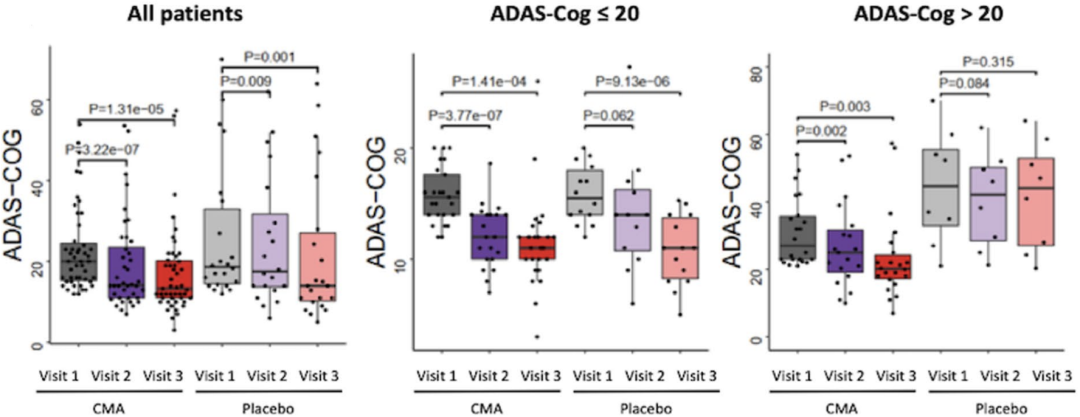
CMA组与安慰剂组受试者ADAS-Cog得分情况
CMA组认知功能的改善也得到了影像学数据的支持。在服用CMA治疗后,CMA组受试者左侧整个海马和海马体分子层的体积保持稳定,而安慰剂组的体积则显著下降。
对于研究的次要终点,在安全性方面,本试验未发生严重不良事件,共有5名受试者报告了不良事件,但均与CMA无关且症状轻微。
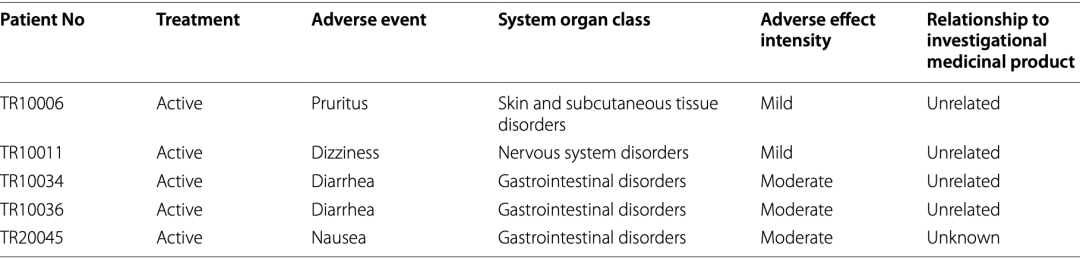
受试者报告的不良事件
AD患者对治疗的反应往往有很大的异质性,本研究中AD患者对CMA的反应同样存在较大差异,因此接下来研究人员试图找到对CMA的治疗反应更明显的临床亚组。
通过对一些血液检查指标的分析,在基线时低丙氨酸氨基转移酶水平、高碱性磷酸酶水平、低 -谷氨酰转肽酶水平、高红细胞压积、高HbA1c水平、高胰岛素水平、高尿酸水平、高嗜碱性粒细胞计数和高红细胞计数,预示着AD患者更有可能从CMA治疗中获益。
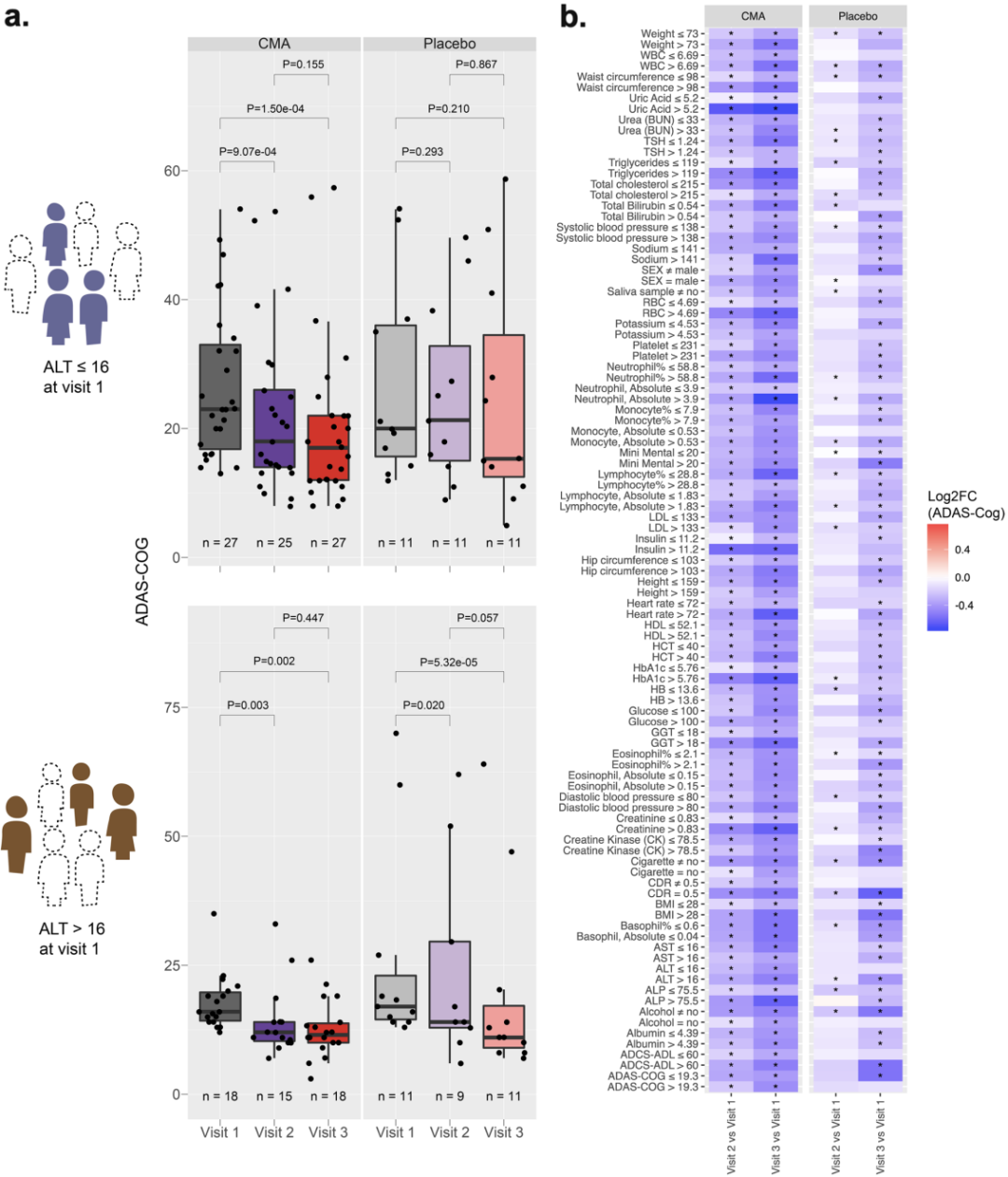
通过分析血液检查指标找到对CMA治疗反应更明显的临床亚组
CMA中的成分均是代谢激活剂,服用之后到底对机体的代谢状态产生了什么影响呢?
通过对服用CMA第84天和基线时的受试者血浆代谢物进行分析,研究人员发现了132种代谢物的血浆水平有显著差异,如N-乙酰天冬氨酸(在维持中枢神经系统能量代谢方面具有重要作用[8])和肌氨酸(甘氨酸衍生物,可改善认知功能[9])在第84天的水平显著高于基线,而喹啉酸(内源性兴奋毒素,可导致神经毒性损伤)在第84天的水平显著低于基线。
总体来看,服用CMA使得AD患者机体的抗氧化损伤、抗炎、脂质代谢等通路(如NAD+和谷胱甘肽通路)明显改善,同时对患者的肾功能起到了一定保护作用(有研究报道肾功能异常与AD之间存在联系[10])。
最后,研究人员对受试者的代谢组学、蛋白质组学和临床数据进行了多组学分析,结果表明CMA确实改变了许多氨基酸(如色氨酸、谷氨酸和支链氨基酸)和脂肪酸(如雄激素)等的代谢,这些代谢物的水平与改善的外周血液指标(如肝功能、全血细胞计数和HbA1c)显著相关,也与认知功能评分的改善明显相关。
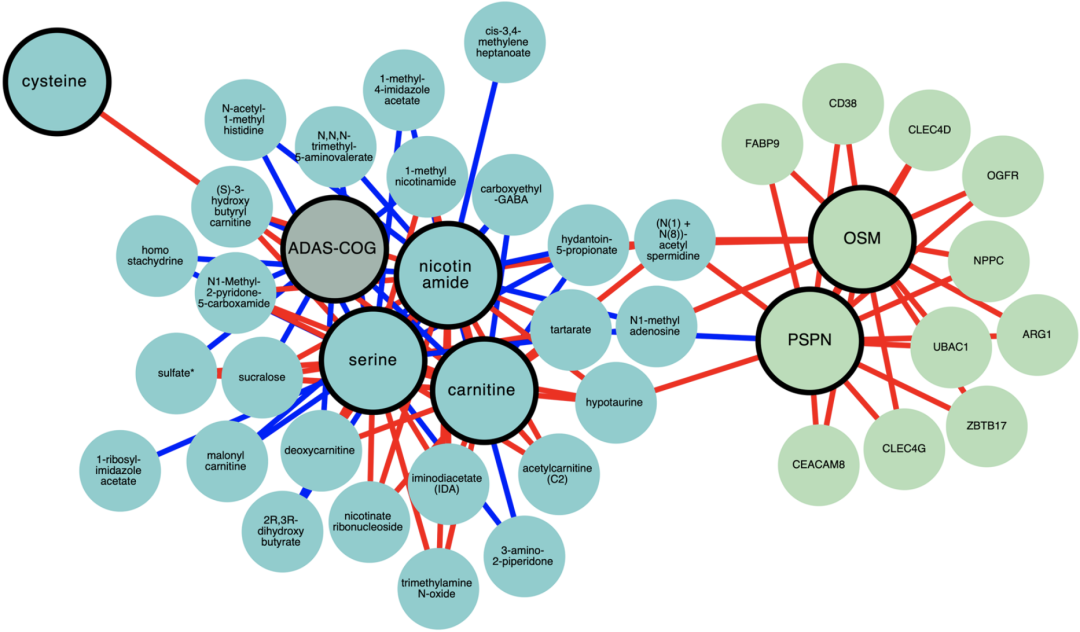
代谢组学、蛋白质组学和临床数据多组学分析
总的来说,本临床试验证明了CMA对于改善轻中度AD患者的认知功能具有一定作用,且这一保护作用在基线认知功能较差的患者中更为明显。
需要指出的是,由于本研究的随访时间仅不到3月,因此今后还需进行更长时间的随访来证明这一疗法的有效性。
参考文献
1.Nunomura A, Perry G: RNA and Oxidative Stress in Alzheimer s Disease: Focus on microRNAs. Oxid Med Cell Longev 2020, 2020:2638130.
2.Arnold SE, Arvanitakis Z, Macauley-Rambach SL, Koenig AM, Wang HY, Ahima RS, Craft S, Gandy S, Buettner C, Stoeckel LE et al: Brain insulin resistance in type 2 diabetes and Alzheimer disease: concepts and conundrums. Nat Rev Neurol 2018, 14(3):168-181.
3.Yulug B, Altay O, Li X, Hanoglu L, Cankaya S, Lam S, Velioglu HA, Yang H, Coskun E, Idil E et al: Combined metabolic activators improve cognitive functions in Alzheimer s disease patients: a randomised, double-blinded, placebo-controlled phase-II trial. Transl Neurodegener 2023, 12(1):4.
4.Pan X, Nasaruddin MB, Elliott CT, McGuinness B, Passmore AP, Kehoe PG, Holscher C, McClean PL, Graham SF, Green BD: Alzheimer s disease-like pathology has transient effects on the brain and blood metabolome. Neurobiol Aging 2016, 38:151-163.
5.Lautrup S, Sinclair DA, Mattson MP, Fang EF: NAD(+) in Brain Aging and Neurodegenerative Disorders. Cell Metab 2019, 30(4):630-655.
6.Toledo JB, Arnold M, Kastenmuller G, Chang R, Baillie RA, Han X, Thambisetty M, Tenenbaum JD, Suhre K, Thompson JW et al: Metabolic network failures in Alzheimer s disease: A biochemical road map. Alzheimers Dement 2017, 13(9):965-984.
7.Ito K, Corrigan B, Romero K, Anziano R, Neville J, Stephenson D, Lalonde R: Understanding placebo responses in Alzheimer s disease clinical trials from the literature meta-data and CAMD database. J Alzheimers Dis 2013, 37(1):173-183.
8.Moffett JR, Arun P, Ariyannur PS, Namboodiri AM: N-Acetylaspartate reductions in brain injury: impact on post-injury neuroenergetics, lipid synthesis, and protein acetylation. Front Neuroenergetics 2013, 5:11.
9.Singh SP, Singh V: Meta-analysis of the efficacy of adjunctive NMDA receptor modulators in chronic schizophrenia. CNS Drugs 2011, 25(10):859-885.
10.Shi Y, Liu Z, Shen Y, Zhu H: A Novel Perspective Linkage Between Kidney Function and Alzheimer s Disease. Front Cell Neurosci 2018, 12:384.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















