Cell Rep Med:通过抑制常规的信号通路或有望改善CAR |
 |
来源:100医药网原创 2023-02-21 11:21
来自新加坡国立大学等机构的科学家们通过研究表示,通过抑制常规的信号通路或许就有望改善CAR-T细胞在治疗实体瘤上的疗效。嵌合抗原受体表达T细胞()疗法涉及重新改造T细胞来靶向作用癌症,该疗法主要会利用患者自身的细胞产生CAR-T细胞,随后对其进行操作修饰来表达CAR基因,并生长到非常高的水平再度输注回患者体内。CAR-T细胞疗法能有效并成功治疗诸如和等血液癌症,但其并不能有效治疗实体瘤,而且这种疗法通常也较为昂贵。因此,为了减少成本并提高人们对CAR-T细胞疗法的可获得性,研究人员就开始开发商业化且现成的CAR-T细胞,其会利用供体机体循环的血液或有时利用脐带血中的T细胞来进行改造。
近日,一篇发表在国际杂志Cell Reports Medicine上题为 CD28-CAR T-cell activation through FYN kinase signaling rather than LCK enhances therapeutic performance 的研究报告中,来自新加坡国立大学等机构的科学家们通过研究表示,通过抑制常规的信号通路或许就有望改善CAR-T细胞在治疗实体瘤上的疗效。
研究者表示,在CAR-T细胞中(CAR-T细胞疗法需要的特定形式的T细胞)存在着诸如CD28的细胞信号蛋白和淋巴细胞特异性蛋白酪氨酸激酶(LCK),细胞信号转导是细胞开启或关闭特定细胞过程和功能的一种特殊过程,其能作为细胞信号通路上的检查点来发挥作用,对于激活细胞来杀灭肿瘤细胞非常重要。为了解决CAR-T细胞疗法疗效和成本的问题,研究人员通过联合研究发现,在携带CD28的CAR-T细胞中,LCK在细胞信号转导过程中是非必要的,当其被干扰时,名为FYN的另一种蛋白就能接管细胞信号。
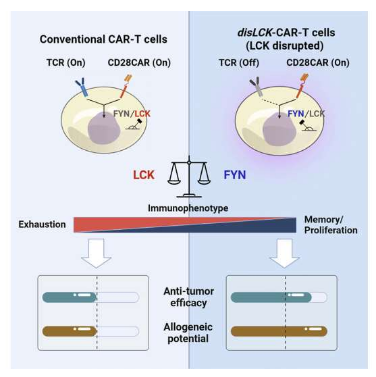
通过抑制常规的信号通路或有望改善CAR-T细胞疗法治疗实体瘤的疗效。
图片来源:Cell Reports Medicine (2023). DOI:10.1016/j.xcrm.2023.100917
而在细胞信号通路中,FYN蛋白是后期的开关之一,然而,由于LCK蛋白在T细胞激活过程中是最主要的开关,在正常的CAR-T细胞中,LCK信号途径通常也是被激活的主要途径,因此当LCK信号被干扰时FYN信号通路就会进行接管。在使用实验室肿瘤模型进行研究时,研究者发现, LCK被干扰的CAR-T细胞会表现出抗肿瘤疗效的增加,而这是FYN信号通路传导的结果,这是因为CAR-T细胞能在体内持续更长时间并会继续杀死肿瘤细胞。
这种信号开关也能为产生现成的CAR-T细胞提供一种新方法,在LCK被干扰的CAR-T细胞中,移植物抗宿主副作用会被移除,这就意味着,如果从供体移植的话,被修饰的CAR-T细胞就无法攻击宿主,也就是受体患者,这将会大大降低CAR-T细胞的生产成本并能使得CAR-T细胞疗法更容易被患者所接受和使用。事实表明,FYN能同时解决CAR-T细胞疗法的疗效和成本问题,其能通过增强攻击实体瘤的能力来改善总体的T细胞功能,与此同时,其还有望用于现成的CAR-T细胞疗法。
研究者Gascoigne教授表示,CAR-T细胞领域在过去30年里取得了巨大的进步,其为癌症疗法带来了非常令人兴奋的希望,基于这一研究发现,CD28 CAR-T细胞疗法或许就能被用于靶向作用诸如和等实体瘤,并能减少CAR-T细胞疗法的费用,这将能极大地改善所有患者对这种疗法的可获得性。综上,本文研究结果表明,CAR-T细胞的非经典信号通路或能提供对TCR和CAR信号通路开启的深入理解,对于后期改善CAR的功能具有非常重要的临床意义。(100yiyao.com)
原始出处:
Ling Wu,Joanna Brzostek,Previtha Dawn Sakthi Vale, et al. , Cell Reports Medicine (2023). DOI: 10.1016/j.xcrm.2023.100917
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















