全球首款!赛诺菲每周1次血友病A疗法获FDA批准上市 |
 |
来源:医药魔方 2023-02-24 15:22
2月23日,赛诺菲宣布,FDA已批准A型血友病治疗药物efanesoctocog alfa的生物制品许可申请(BLA),这是一种first-in-class高持续性的凝血因子VIII替代疗法。 2月23日,赛诺菲宣布,已批准A型血友病治疗药物efanesoctocog alfa的生物制品许可申请(BLA),这是一种first-in-class高持续性的凝血因子VIII替代疗法。FDA曾授予Efanesoctocog alfa、快速通道资格以及孤儿药资格。
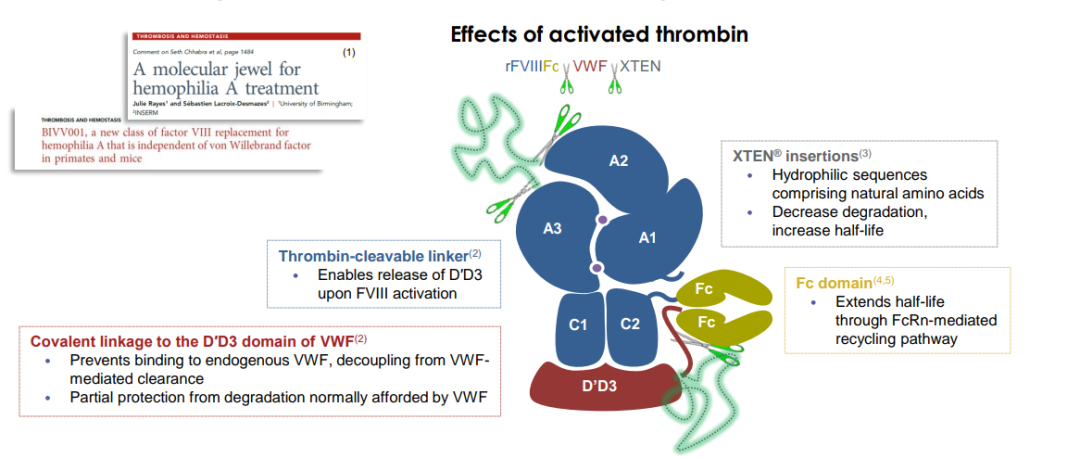
Efanesoctocog alfa(商品名:ALTUVIIIO)是一款新型的凝血因子VIII疗法,通过将凝血因子VIII与Fc、性血友病因子(vWF)部分区域和XTEN多肽片段融合在一起,克服vWF对FVIII半衰期延长限制,显著延长药品在血液循环内的时间。该疗法旨在通过每周1次的预防性给药,维持正常的FVIII活性水平以延长对A型血友病患者的出血保护。
 此次上市申请是基于一项开放标签、多中心的III期研究(XTEND-1)数据。该研究纳入了159例12岁及以上患者,旨在评估每周1次接受efanesoctocog alfa对既往接受过凝血因子VIII(FVIII)替代疗法的严重A型血友病患者的安全性、有效性和药代动力学特征。
此次上市申请是基于一项开放标签、多中心的III期研究(XTEND-1)数据。该研究纳入了159例12岁及以上患者,旨在评估每周1次接受efanesoctocog alfa对既往接受过凝血因子VIII(FVIII)替代疗法的严重A型血友病患者的安全性、有效性和药代动力学特征。
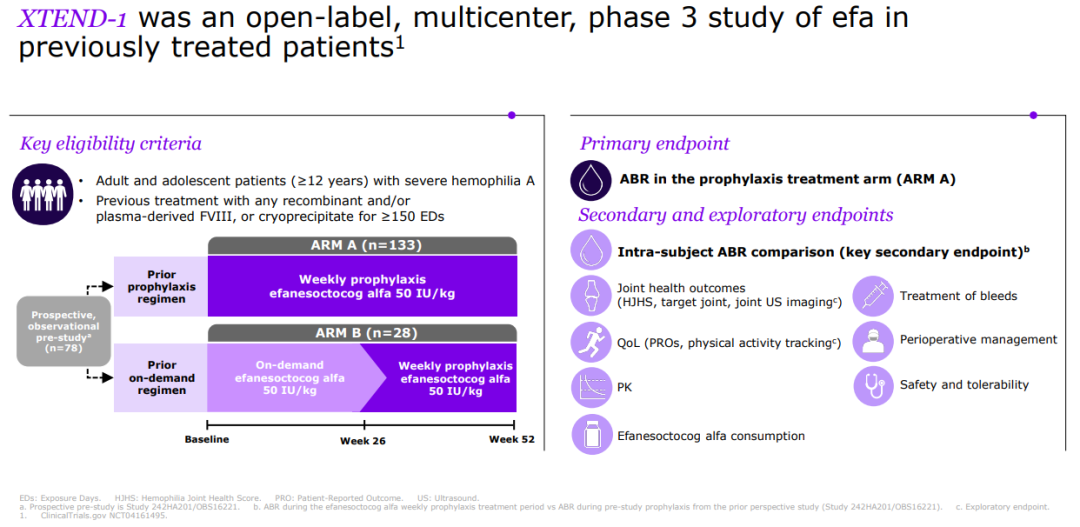
XTEND-1设有两个平行组:A组即预防组(n=133)的成员每周给予50 IU/kg Efanesoctocog alfa,持续 52 周;B组即按需组(n=26)的成员最初根据需要给予50 IU/kg,持续 26 周,之后变成每周一次给药,持续 26 周。
该研究的主要终点是A组的年出血率(ABR)。结果显示,在每周接受一次efanesoctocog alfa预防性治疗的A组患者中,52周内中位年出血率(ABR)为0,平均ABR为0.70,达到了具有临床意义的出血预防的主要终点。
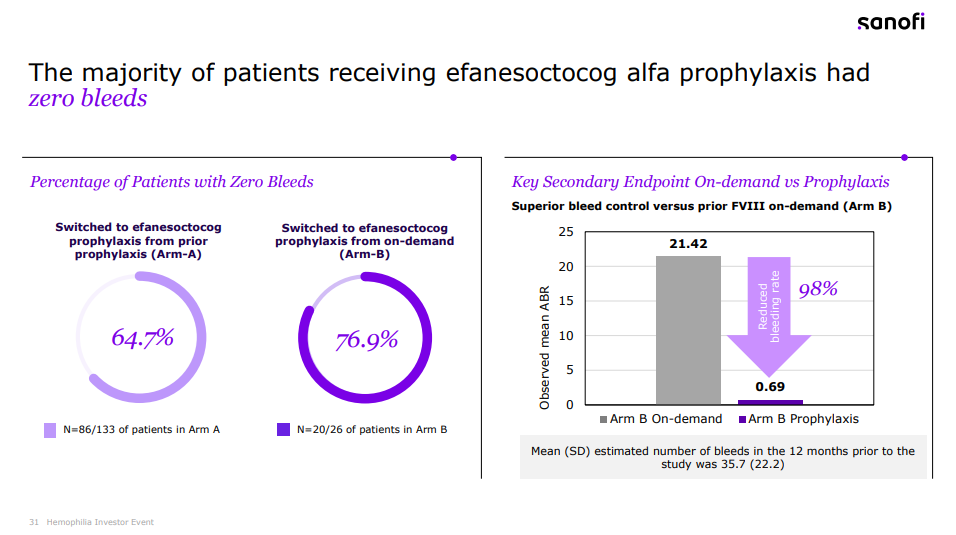
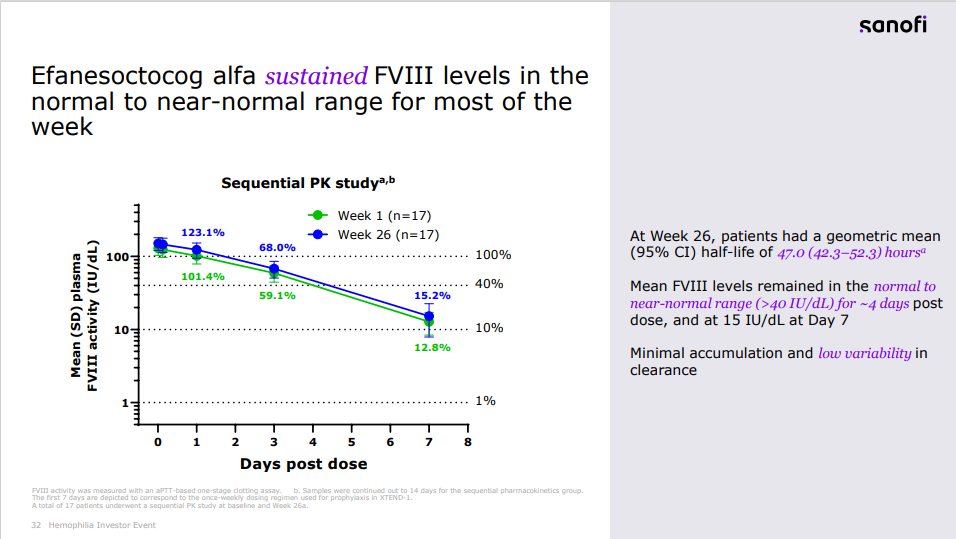
相较于先前预防性FVIII替代治疗,efanesoctocog alfa在预防出血事件方面表现出优效性。在一周的大部分时间里,efanesoctocog alfa可以维持FVIII水平在正常至接近正常范围内。
此外,XTEND-Kids的中期数据显示,12岁以下的儿童每周接受一次efanesoctocog alfa,持续26周(n=23),平均ABR为0.5,中位ABR为0。
赛诺菲首席执行官Paul Hudson表示: 今天Efanesoctocog alfa的获批使患者和医生能够重新定义血友病患者的生活。通过每周一次的剂量,Efanesoctocog alfa可持续性实现的凝血因子活性水平,有望改变血友病患者的出血状况。 版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















