《细胞·代谢》:亚油酸惊现独门抗癌绝技!科学家首次发现,亚油酸能改善T细胞代谢,防止其耗竭,并促进其分化成记忆T细胞 |
 |
《细胞·代谢》:亚油酸惊现独门抗癌绝技!科学家首次发现,亚油酸能改善T细胞代谢,防止其耗竭,并促进其分化成记忆T细胞
来源:奇点糕 2023-03-16 13:28
Manzo团队的这个研究首次阐明了亚油酸调控CD8+T细胞代谢和分化的机制,证实了亚油酸对CD8+T细胞有独一无二的积极影响。对于临床治疗而言,亚油酸处理过继性T细胞,或许是一个值得尝试的增强抗癌效果提起亚油酸,大家首先想到的肯定是有益于心健康。
你肯定想不到的是,亚油酸可能还是个未被发现的抗癌高手。
近日,由欧洲肿瘤研究所Teresa Manzo领衔的研究团队,在著名期刊《细胞 代谢》上发表了一项重要研究成果[1]。
他们发现,亚油酸(LA)是CD8+T细胞(CTL)活性的正向调节分子,它能改善T细胞的代谢能力,防止T细胞耗竭,并刺激T细胞向效应功能强大的记忆样表型分化。值得一提的是,Manzo团队还发现,亚油酸的这一技能竟然是独一无二的,其他的脂质没有这样的功能!
更厉害的是,用亚油酸处理细胞,可以让CAR-T细胞持久保持抗癌能力。因此,Manzo等认为,亚油酸或许可以作为过继性T细胞抗癌疗法的增效剂。

论文首页截图
Manzo是欧洲肿瘤研究所研究代谢和癌症免疫治疗的年轻PI,她主要研究方向是T细胞的代谢与癌症免疫,其中脂质对T细胞代谢的影响就是她的研究方向之一。
早在2020年的时候,Manzo发现特定的长链脂肪酸(LC-FAs)会损害CD8+T细胞线粒体的完整性和功能,导致T细胞耗竭、抗肿瘤能力受损[2]。因此,她想知道是不是所有的长链脂肪酸都对T细胞有害。这一次,她把目光投向了被认为是健康脂肪酸的亚油酸。

Teresa Manzo(图源:欧洲肿瘤研究所)
在比较未被激活的CD8+T细胞和处于激活状态的CD8+T细胞的亚油酸水平之后,Manzo团队发现处于激活状态的CD8+T细胞中亚油酸水平下降了。因此,她认为亚油酸在T细胞激活的过程中被消耗掉了。
随后,她们用人体生理浓度水平(100 M)的亚油酸处理CD8+T细胞。没想到,仅在亚油酸处理的6小时后,T细胞的线粒体数量就爆发式增加。不仅如此,与对照组相比,线粒体的质量和代谢能力也变好了。
简单来说,亚油酸处理之后,T细胞的 能量工厂 更多、更强了!
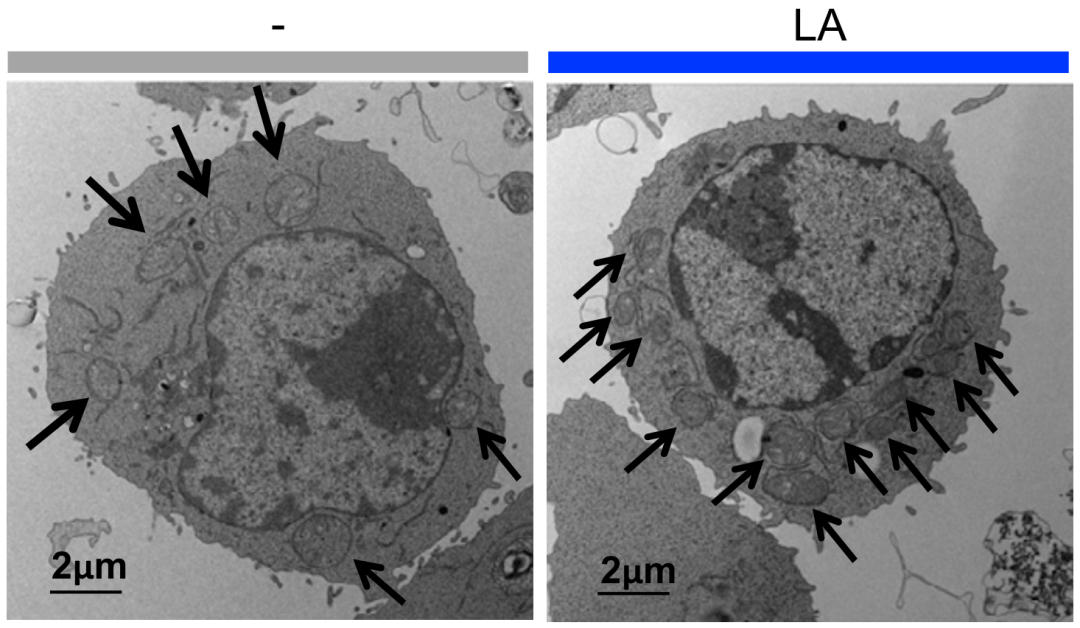
亚油酸(LA)处理后,T细胞线粒体的质变和量变
那么作为一种长链脂肪酸,亚油酸是如何改善T细胞线粒体功能的呢?
Manzo团队通过多种技术手段证实,原来亚油酸可以插入到线粒体和内质网的膜中,导致线粒体和内质网膜重塑,促进二者发生膜融合,形成一种叫做内质网-线粒体接触(MERC)的结构。
之前已经有研究发现,MERC这个结构恰好可以调节CD8+T细胞线粒体的功能[3],而且可以控制Ca2+从内质网到线粒体运输[4],对T细胞的激活、迁移和TCR信号传导至关重要[5]。
如此看来,亚油酸可能通过对线粒体,对CD8+T细胞的功能产生了重要的影响。
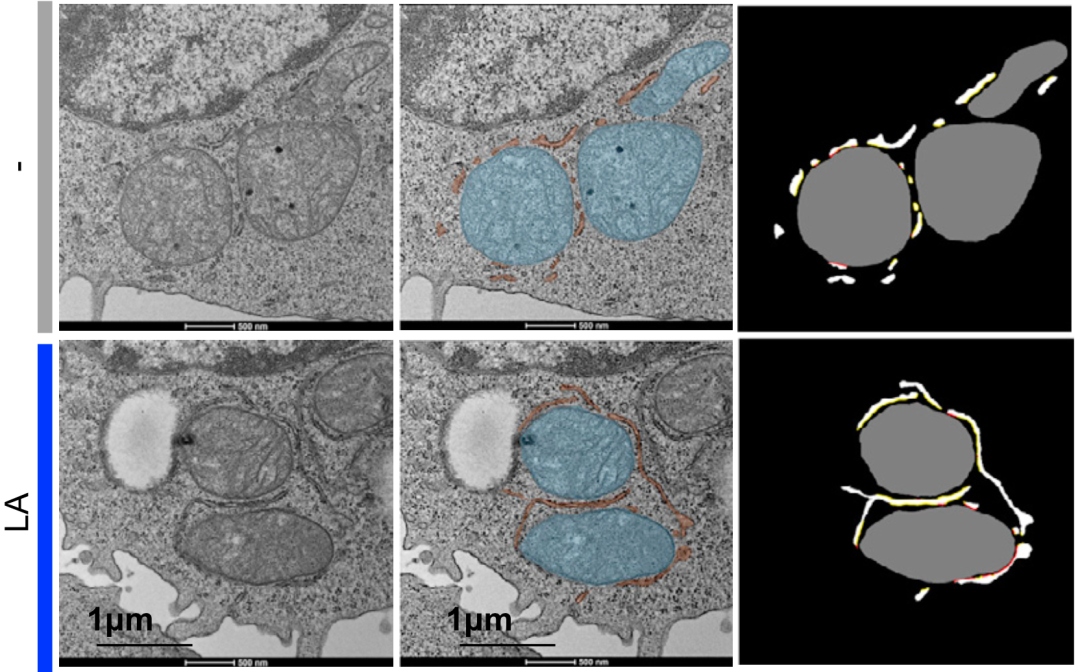
亚油酸(LA)处理后,内质网和线粒体的接触更多了
那么亚油酸处理后,T细胞究竟会发生那些变化呢?
体外研究数据表明,那些经过亚油酸 洗礼 的CD8+T细胞,竟表现出了长寿记忆性T细胞的特征。不过,这些T细胞的增殖能力、典型激活标志物或效应细胞因子(即GZM 、IFN 、TNF 、IL2和穿孔蛋白等)方面却没有变化。这说明亚油酸并不激活CD8+T细胞,但促进它们向记忆T细胞分化。
尽管如此,Manzo团队还是发现与对照组相比,亚油酸处理让T细胞更有生存优势,而且具备了多能性(能同时产生多达5种效应细胞因子)。这些都是典型的记忆性T细胞的特征。
让Manzo和她的同事吃惊的是,在反复的刺激下,亚油酸处理的T细胞PD-1表达水平持续显著下降,而且这种下降并不是因为T细胞激活状态下调导致的。这说明,亚油酸可以让T细胞避免耗竭问题。
事实也确实如此,在T细胞和癌细胞的比例为1:1时,对照组和亚油酸处理的T细胞都能很好的杀死癌细胞,但是当这一比例提高到1:4的时候,对照组的T细胞就瘫痪了,而亚油酸处理的T细胞依旧保持强大的杀伤力。
将以上数据汇总之后,Manzo团队列出了一个时间线:亚油酸处理之后,在短短2小时内强烈影响了内质网;随后,在第6个钟头,线粒体数量暴增,同时形成MERC;到第12个钟头,CD8+T细胞的抗癌能力就获得了提升。重要的是,亚油酸对人体CD8+T细胞有相似的影响。
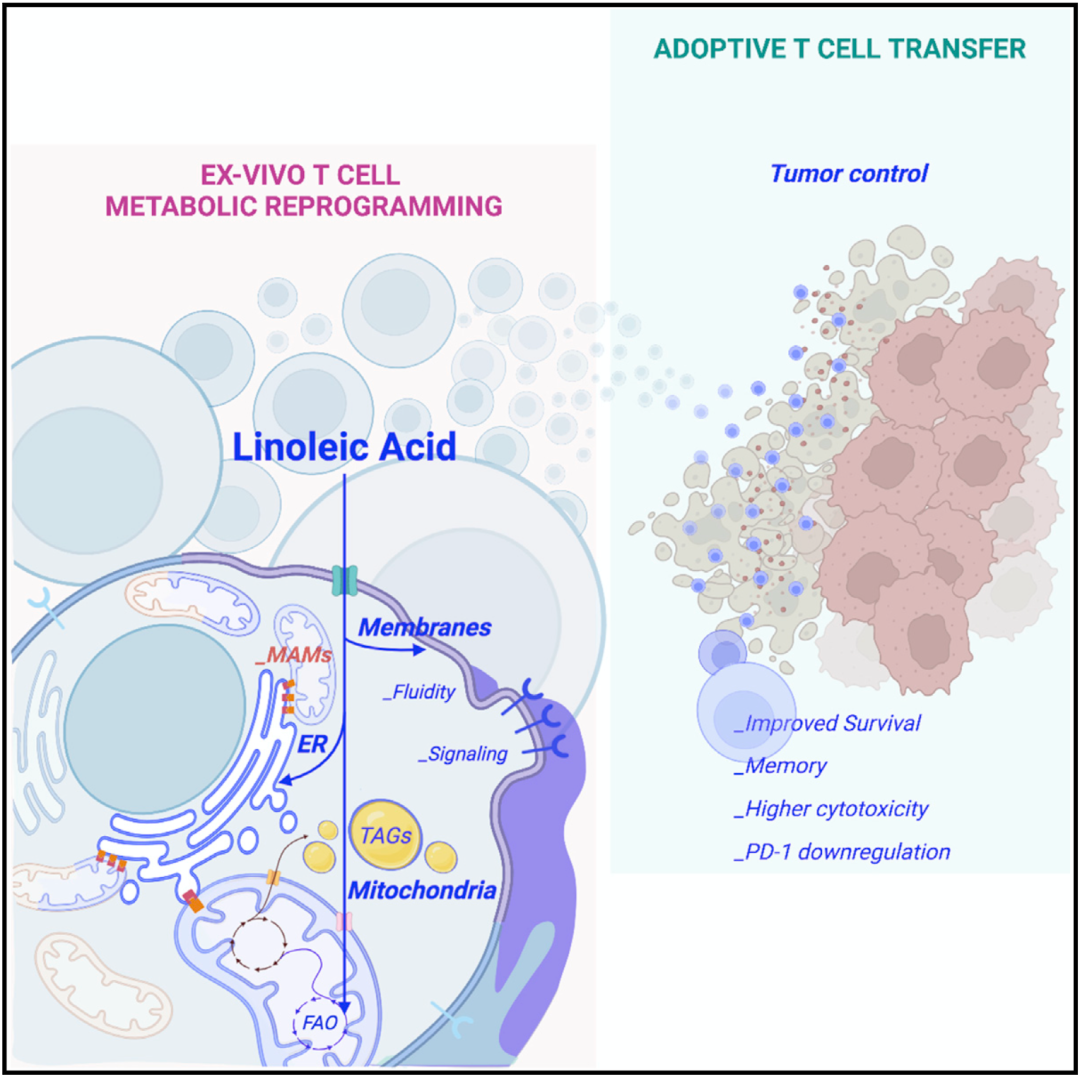
机制示意图
在研究的最后,Manzo团队测试了亚油酸对CAR-T细胞抗癌能力的影响。
她们测试了三种CAR-T细胞:用于治疗非霍奇金的CD30.CAR-T;用于治疗神经母细胞瘤、高级别胶质瘤和肉瘤的GD2.CAR-T;以及用于治疗急性淋巴细胞和弥漫性大B细胞淋巴瘤的CD19.CAR-T。
她们发现,当CAR-T细胞与肿瘤细胞以1:1比例进行共培养时,亚油酸处理和对照组CAR-T细胞都显示出高效的杀伤力。然而,当与更高比例的肿瘤细胞(1:2和1:4)培养时,只有亚油酸处理的CAR-T细胞保持了细胞毒性能力。这意味着亚油酸增强了CAR-T细胞的功能。
在用CD30.CAR-T治疗淋巴瘤小鼠模型时,对照组CAR-T不能控制肿瘤的负担,而亚油酸处理的T细胞有效地控制住了肿瘤。
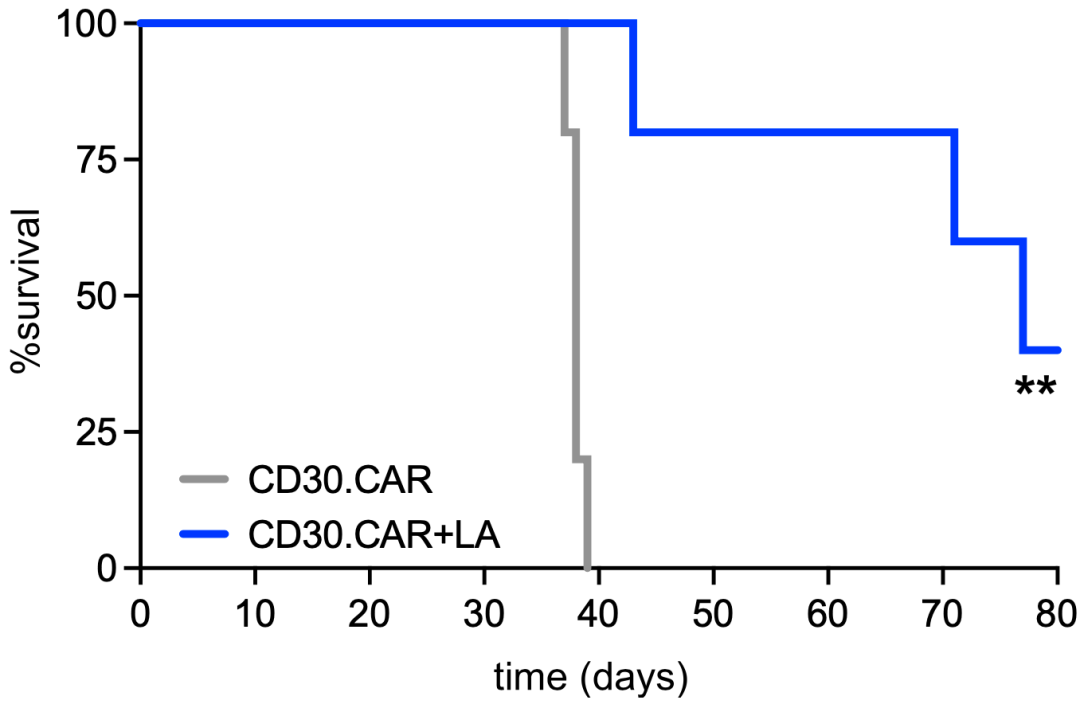
亚油酸增强了CAR-T细胞的功能
总的来说,Manzo团队的这个研究首次阐明了亚油酸调控CD8+T细胞代谢和分化的机制,证实了亚油酸对CD8+T细胞有独一无二的积极影响。对于临床治疗而言,亚油酸处理过继性T细胞,或许是一个值得尝试的增强抗癌效果的方法。
最后,我们在强调一点。这个研究没有证明吃亚油酸可以抗癌,而是证明了亚油酸处理可以增强T细胞的抗癌能力。所以,请大家不要盲目补充亚油酸,在日常生活中做到均衡营养即可。
参考文献:
[1].Nava Lauson CB, Tiberti S, Corsetto PA, et al. Linoleic acid potentiates CD8+ T cell metabolic fitness and antitumor immunity. Cell Metab. 2023. doi:10.1016/j.cmet.2023.02.013
[2].Manzo T, Prentice BM, Anderson KG, et al. Accumulation of long-chain fatty acids in the tumor microenvironment drives dysfunction in intrapancreatic CD8+ T cells. J Exp Med. 2020;217(8):e20191920. doi:10.1084/jem.20191920
[3].Bantug GR, Fischer M, Gr hlert J, et al. Mitochondria-Endoplasmic Reticulum Contact Sites Function as Immunometabolic Hubs that Orchestrate the Rapid Recall Response of Memory CD8+ T Cells. Immunity. 2018;48(3):542-555.e6. doi:10.1016/j.immuni.2018.02.012
[4].Masud A, Mohapatra A, Lakhani SA, Ferrandino A, Hakem R, Flavell RA. Endoplasmic reticulum stress-induced death of mouse embryonic fibroblasts requires the intrinsic pathway of apoptosis. J Biol Chem. 2007;282(19):14132-14139. doi:10.1074/jbc.M700077200
[5].Missiroli S, Patergnani S, Caroccia N, et al. Mitochondria-associated membranes (MAMs) and inflammation. Cell Death Dis. 2018;9(3):329. Published 2018 Feb 28. doi:10.1038/s41419-017-0027-2
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 明眸皓齿打一个正确的生肖,最佳资询落实 (2025-09-13)
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















