JEV:清华大学尹航团队揭示细胞外囊泡调控STING天然免疫信号通路的新机制 |
 |
来源:生物世界 2023-03-27 09:12
该研究发现,STING在激活后,能够以寡聚体的形式进入细胞外囊泡(EVs);同时,研究鉴定得到内吞体转运复合体(ESCRT)的元件STAM蛋白能够结合STING的寡聚体,并将其转运到EVs中细胞外囊泡(EVs)是一种重要的亚细胞结构,它是一类能够被绝大多数细胞分泌,广泛存在于各种体液包括血清、血浆、尿液等的膜性小泡,其直径在大约50-150nm左右,表面存在一系列跨膜四蛋白的标志物,包括CD9、CD63、CD81等。
EVs已被证明能够通过其携带脂质、蛋白、核酸、糖链等一系列生物活性物质,介导细胞间通讯等重要的生物学过程。EVs参与生物体系内各种机制的调控,天然响应是机体抵抗病原微生物入侵的第一道防线,在相关疾病的发生发展中起到关键作用。诸多研究表明,EVs能够通过携带的各种内容物,调控天然免疫信号响应。
在天然免疫应答中,干扰素基因刺激因子(STING)信号通路在抗病毒天然免疫以及等过程中发挥重要作用。STING信号通路的调控对于机体的免疫稳态至关重要,STING的异常激活可能会导致STING相关幼年发病性病变(SAVI)、系统性红斑狼疮(SLE)、Aicardi-Gouti res综合征(AGS)等疾病。近年来,诸多研究报道,STING的亚细胞定位(包括溶酶体、自噬小体等)与其信号通路的精准调控密切相关。然而STING在EVs这一广泛参与天然免疫调控的亚细胞结构中的定位与功能却仍所知甚少。
2023年3月22日,清华大学药学院尹航团队在细胞外囊泡领域旗舰期刊Journal of Extracellular Vesicles上发表了题为:STAM transports STING oligomers into extracellular vesicles, down-regulating the innate immune response的研究论文。
该研究发现,STING在激活后,能够以寡聚体的形式进入细胞外囊泡(EVs);同时,研究鉴定得到内吞体转运复合体(ESCRT)的元件STAM蛋白能够结合STING的寡聚体,并将其转运到EVs中;最终,该研究表明STAM负调控STING信号通路,说明了STAM协助STING进入EVs并被降解的过程,是一种STING在激活后的适时终止,达到精准调控的机制。

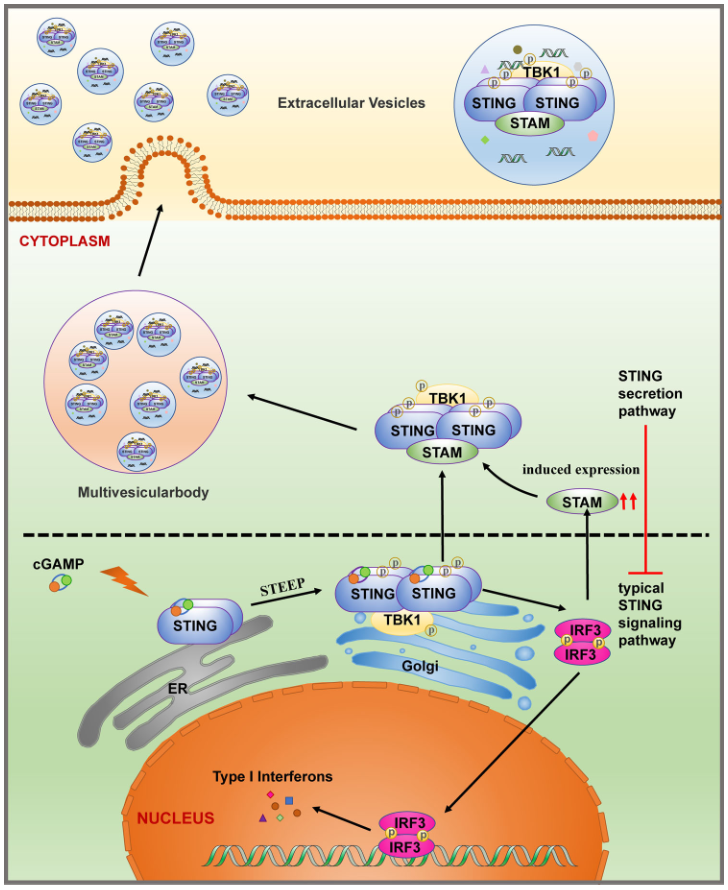
STAM协助STING寡聚体进入EVs,防止STING信号通路过度激活
研究团队通过超速离心的方法分离得到了STING信号通路激活后的细胞分泌产生的EV,结合生化实验验证,确认了STING在激活后能够通过多囊泡体途径进入EVs。进一步通过非变性凝胶电泳(Native PAGE)确认了EVs中的STING是以寡聚体的形式存在。

STING在激活后以寡聚体形式分泌进入EVs。左:STING在激活后能够通过多囊泡体途径进入EVs;右:EVs中的STING是以寡聚体的形式存在
在明确现象后,研究团队着手深入探索协助STING寡聚体进入EVs的分子机器。通过构建了一系列稳定敲降基因的细胞系,研究者筛选得到了ESCRT中的元件STAM能够协助STING的寡聚体进入EVs。而进一步生化实验说明,STING在激活后形成的寡聚体能够与STAM发生直接结合,并使STAM发生诱导表达。
在阐明现象和机制后,研究团队开始研究其中的生物学功能。通过一系列的细胞生物学工具,研究团队发现,EVs中的STING几乎全部与受体细胞的溶酶体共定位,说明STING进入EVs最终可能被受体细胞的溶酶体所降解。而细胞水平的生化检测也说明STAM能够负调控STING信号通路。这就说明了STAM协助STING进入EVs并被降解的过程,是一种STING在激活后的适时终止,达到精准调控的机制。
EVs最早是在网织红细胞中被发现,当时,研究人员认为其是细胞释放的 垃圾袋 ,用以消除细胞内的多余而无用的物质。近年来,随着EVs内容物的研究逐渐增多,对于EVs的研究也开始侧重于讨论EVs在细胞间通讯中所起到的功能,这也导致了EVs最原始的功能被渐渐忽视。
该研究表明EVs在天然免疫信号调控中也会发挥其原始功能,与介导细胞间通讯的机制共同对生物学平衡进行精准调控。该研究也加深了对于STING信号通路的调控的认识,并为相关疾病的理解与治疗提供基础。
论文通讯作者为清华大学药学院尹航教授,第一作者为博士研究生梁家琦。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- “脂质溢出”是元凶?10月30日直播预告:揭秘肥胖代谢共病背后的真相 (2025-10-27)
- Science:我国科学家揭示人类跳跃基因LINE-1靶向结构化DNA来重塑基因组 (2025-10-27)
- 警惕“超级大肠杆菌”!它堵死肠道细胞“自我牺牲路”,新研究破解抗耐药密码 (2025-10-27)
- Nature Genetics:我们沿用20年的小鼠参考基因组,究竟错过了什么?一份T2T图谱的完整答案 (2025-10-26)
- 情感传染!南方医科大学最新论文登上Science封面 (2025-10-26)
- Nature Biotechnology:数据基准与算法创新的双轮驱动——DeepSomatic研究定义的基因组学发现新范式 (2025-10-25)
- Nature:当饥饿遇上荷尔蒙——大脑如何权衡母爱与生存? (2025-10-25)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 《柳叶刀》:减肥神药,暗藏护心秘法!迄今最大规模临床试验证实,司美格鲁肽的心脏保护作用与基线肥胖和体重减轻无关,或有独特保护机制 (2025-10-24)
- Cell子刊:脂肪细胞脂解,激活上皮干细胞,促进毛发再生 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















