AJRCCM:科学家首次利用干细胞技术制造出离子转运细胞 有望开发出治疗人类囊性纤维化的新型疗法 |
 |
AJRCCM:科学家首次利用干细胞技术制造出离子转运细胞 有望开发出治疗人类囊性纤维化的新型疗法
来源:100医药网原创 2023-05-10 15:24
来自波士顿儿童医院等机构的科学家们通过研究首次利用干细胞技术在患者机体中制造出了离子转运细胞(ionocytes),这一研究成果意味着如今研究人员就能在培养皿中研究离子转运细胞,从而理解其生物学特性。囊性纤维化跨膜转导调节子(CFTR,Cystic fibrosis transmembrane conductance regulator)调节器是囊性纤维化研究的一大突破,其能改善氯化物和水的流动并促进湿润粘膜的分泌物,然而这些药物非常昂贵,但并不会在所有囊性纤维化患者机体中发挥作用,且会带来机体副作用并与其它药物相互作用,对CFTR调节器能产生反应的人群必须终生服用药物。于是研究者Ruby Wang博士等人就设想了一种可替代的策略,即靶向作用最近才被发现的一种细胞类型的细胞疗法或基因疗法。
早在2018年,发表在Nature杂志上的两篇研究报告就震惊了从事囊性纤维化研究的众多科学家,当时研究人员发现,CFTR基因突变主要会影响离子转运细胞(ionocytes),此前其是一种不为人知的细胞类型,且在机体气道中仅占比1%,让研究人员惊讶的是,有超过90%的CFTR蛋白都是由这些罕见细胞所制造的。如今,一篇发表在国际杂志American Journal of Respiratory and Critical Care Medicine上题为 De Novo Generation of Pulmonary Ionocytes from Normal and Cystic Fibrosis Human Induced Pluripotent Stem Cells 的研究报告中,来自波士顿儿童医院等机构的科学家们通过研究首次利用技术在患者机体中制造出了离子转运细胞(ionocytes),这一研究成果意味着如今研究人员就能在培养皿中研究离子转运细胞,从而理解其生物学特性,并有望让其作为一种治疗工具发挥更大用途。
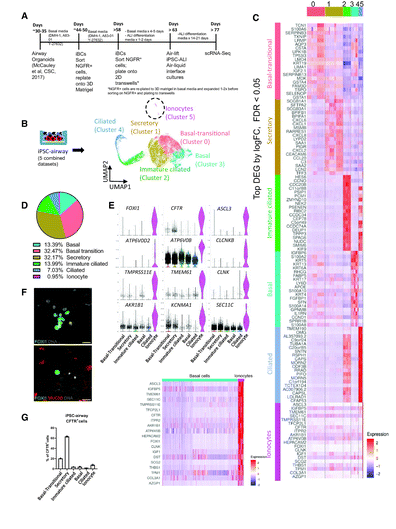
科学家首次利用干细胞技术制造出离子转运细胞 有望开发出治疗人类囊性纤维化的新型疗法。
图片来源:American Journal of Respiratory and Critical Care Medicine (2023). DOI:10.1164/rccm.202205-1010LE
研究者Wang说道,未来或许我们就能纠正患者机体的离子转运细胞并将其放回肺部组织中,离子转运细胞能在囊性纤维化中发挥关键作用的想法最初引发了科学家们强烈的怀疑态度,那么这样一种不常见的细胞如何能帮助保持肺部的通常?气道中的纤毛细胞会推动粘液沿着气道移动,其似乎是一种合乎逻辑的目标细胞。Wang指出,当我在医学院时,研究人员普遍认为CFTR突变存在于纤毛细胞中,我们当时并不相信离子转运细胞,也并不指望能制造出离子转运细胞。
当让大家惊讶的是,如今科学家们竟然做到了,从患者机体的血细胞开始,研究者Wang及其同事制造出了诱导多能干细胞,随后他们指导这种干细胞逐步分化,首先通过一种此前发表的文章中的步骤制造产生了气道基底样细胞(iBCs),出乎意料的是,修改步骤并刺激iBCs就能产生携带高水平CFTR蛋白的离子转运细胞。在培养皿中,这些离子转运细胞有着很长的延伸,这就有点像神经元,这就让研究人员推测,其或许正在与其它细胞相互交谈并影响其它细胞的功能,研究者Wang认为,后期他们还需要更多的时间来阐明其确切作用。
目前研究人员还会继续深入研究来阐明离子转运细胞的发育起源和功能,其非常难以研究因为这种细胞非常罕见。研究人员制定了一种肺部细胞治疗计划,旨在寻找治疗肺部疾病的可替代疗法,而掌握最相关的受影响细胞以及利用一种对其进行研究的基于人类细胞的平台,进行人类囊性纤维化的研究或许就是第一个测试的案例。(100yiyao.com)
原始出处:
Ruobing Wang,Chantelle Simone-Roach,Jonathan Lindstrom-Vautrin, et al. , American Journal of Respiratory and Critical Care Medicine (2023). DOI:10.1164/rccm.202205-1010LE
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















