研究揭示拟南芥RNA聚合酶V的转录延伸机制 |
 |
《自然-通讯》(Nature Communications)在线发表了中国科学院分子植物科学卓越创新中心/中科院合成生物学重点实验室张余研究组撰写的题为A cryo-EM structure of KTF1-bound polymerase V transcription elongation complex的研究论文。该研究报道了包含KTF1的RNA聚合酶V(RNA polymerase V; Pol V)转录延伸复合物的高分辨率冷冻电镜结构,为剖析Pol V转录延伸奠定了结构基础。
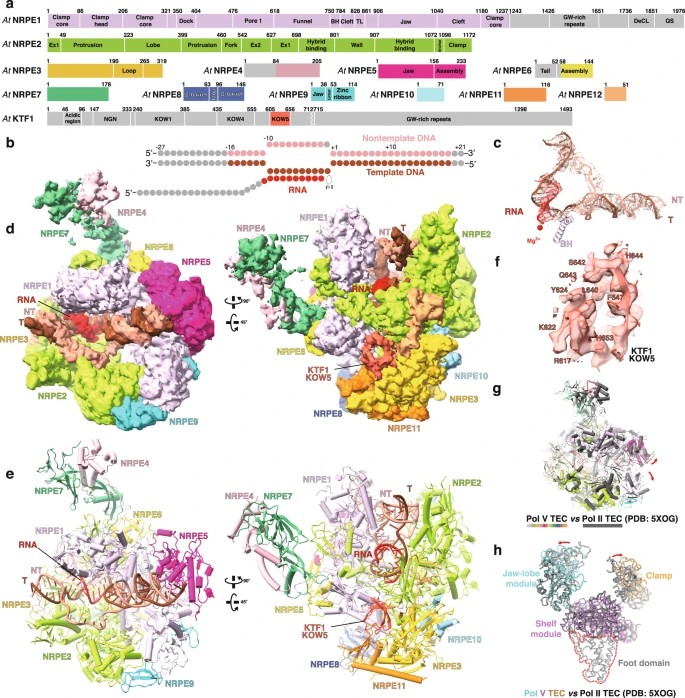
陆地植物通过RNA介导的DNA甲基化通路(RNA-directed DNA methylation pathway,RdDM)建立和部分维持基因组DNA甲基化。该通路中,基因组DNA甲基化与Pol V的转录延伸过程紧密偶联,Pol V转录延伸过程通过两个层次的相互作用招募Argonaute4/6-siRNA复合物。第一个层次是Pol V-KTF1和Argonaute 4/6蛋白的直接相互作用。该相互作用涉及Pol V和KTF1中包含GW基序的结构域。第二个层次是Pol V转录产生的long non-coding RNA与Argonaute4/6携带的siRNA序列匹配。进而,上述复合物进一步招募DNA甲基化转移酶DRM2在Pol V的转录区域进行DNA甲基化修饰(图1)。Pol V由Pol II进化而来,但其转录活性低于Pol II,其转录的基因组区域以及相互作用的转录调控蛋白和Pol II有显著区别。
Pol V-KTF1转录延伸复合物的冷冻电镜结构显示,Pol V具有和Pol II类似的活性中心,但Pol V活性中心的结构单元和Pol II具有构象差异。研究推测这一差异与Pol V的较弱转录活性相关。该研究进一步表明Pol V具有独特的结构特征,而该特征阻止其与Pol II的通用转录因子(TFIIB、TFIID、TFIIE、TFIIH、TFIIS)以及Pol IV的转录偶联因子(RDR2)相互作用,解释了Pol V相较Pol II以及Pol IV功能的独特性。此外,该研究揭示了KTF1的KOW5结构域和Pol V之间的相互作用,KTF1的KOW5结构域结合在Pol V的RNA退出通道附近。这一结合方式使KTF1 的C端GW结构域指向Pol V转录RNA的5 末端,从而便于其招募携带siRNA的AGO4/6。该成果为Pol V的转录特征提供了结构解释,为进一步研究Pol V转录延伸偶联的DNA甲基化过程奠定了基础。
研究工作得到国家重点研发计划和上海市基础研究特区计划项目的支持。

- 相关报道
-
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 《自然·衰老》:又发现近300种蛋白与阿尔茨海默病相关,7蛋白模型预测AD状态AUC最高可达0.88! (2025-06-07)
- 刷新记录!瑞康曲妥珠单抗获批治疗HER2突变非小细胞肺癌,中国患者迎来高效低毒新疗法 (2025-06-07)
- 你是一喝酒就脸红吗?多项研究:喝酒脸红者更易衰老、出现大脑中Aβ病理加重、炎症因子分泌减少等问题,增加阿尔茨海默病发生风险 (2025-06-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















