《癌症研究》:仁济医院团队揭示二甲双胍抗肠癌新机制!通过干预色氨酸代谢重塑免疫微环境! |
 |
《癌症研究》:仁济医院团队揭示二甲双胍抗肠癌新机制!通过干预色氨酸代谢重塑免疫微环境!
来源:奇点糕 2023-06-14 08:48
仁济医院团队开展的本次研究,揭示了二甲双胍调节肠癌细胞色氨酸代谢的全新机制,进一步解释了二甲双胍重塑肠癌免疫微环境,特别是增强CD8+T细胞免疫功能的作用,至于如何更好地从色氨酸代谢入手调节抗肿瘤免疫这款 老牌神药 的抗癌功效,各位这几年肯定都听过不少,但其实二甲双胍最确切的抗癌功效之一,早在2016年就被证实:一项临床III期随机对照研究显示,低剂量服用二甲双胍1年,能有效降低癌前病变发生率[1]。
学界普遍认为,二甲双胍抗肠癌的功效与其增强抗肿瘤有关,上海交通大学医学院附属仁济医院内科杜婉、熊华团队,近期就在知名期刊Cancer Research上发表最新研究,揭示了 神药 正向调控肠癌免疫微环境的新机制。
研究者们发现,二甲双胍能通过下调MYC基因表达,抑制结直肠癌细胞的色氨酸摄取能力,帮CD8+T细胞从癌细胞口中抢走更多色氨酸,从而重塑肠癌免疫微环境,扩增CD8+T细胞数量并增强其细胞毒性,助力抗应答[2]。

论文首页截图
既往已有研究显示,二甲双胍可调节肿瘤微环境中癌细胞和免疫细胞的葡萄糖、脂肪酸代谢[3-4],那么同为三大营养物质,二甲双胍是否会影响组成蛋白质的氨基酸代谢呢?要知道,T细胞如果摄取不到足够的氨基酸,在抗肿瘤免疫时的 打工 状态也会受影响[5],如果二甲双胍能在这方面出把力就太好了。
基于上述假设和既往研究经验,仁济医院研究团队对小鼠正常结肠组织开展了单细胞测序,发现CD8+T细胞在二甲双胍处理组小鼠的肠道中显著增多,而CD4+T细胞较对照组减少,同时B细胞和髓系细胞组分也有一定的改变。
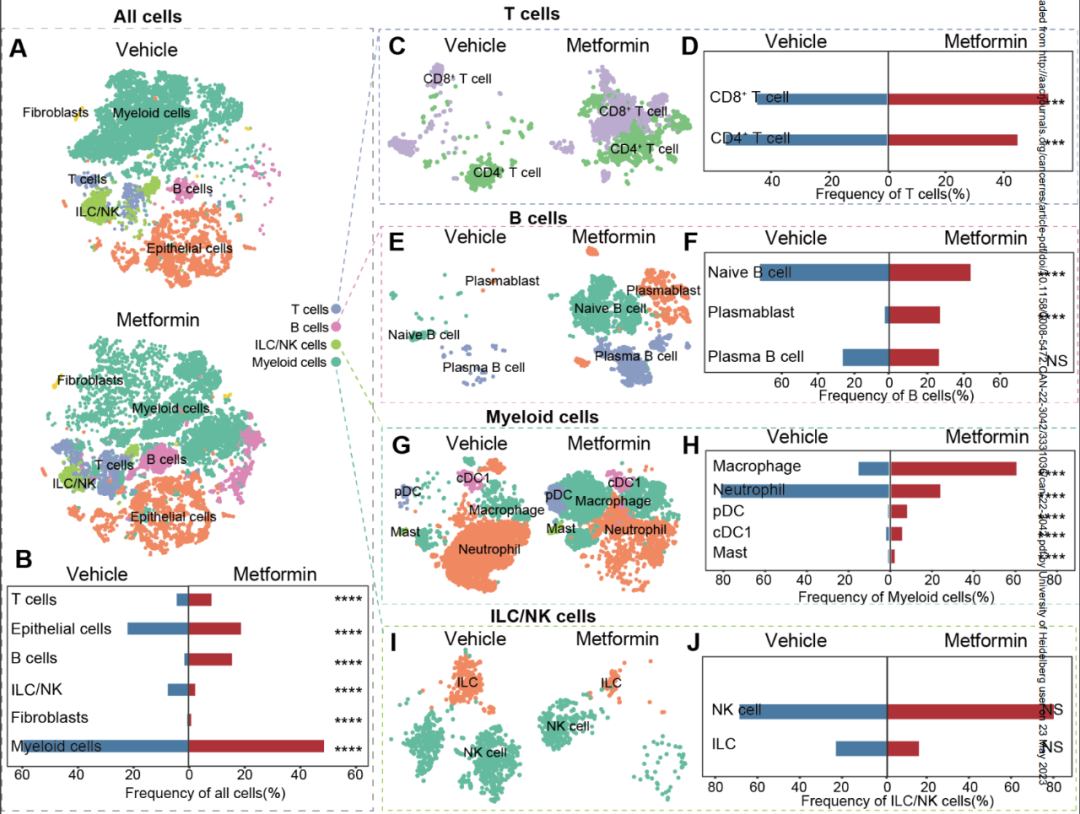
二甲双胍对免疫细胞占比的影响
这些发现能再次确认二甲双胍重塑肠道免疫微环境的作用,接下来的重点是找到具体的作用机制。基因集富集分析(GSEA)显示,二甲双胍处理后肠上皮细胞和CD8+T细胞的氨基酸代谢状况存在显著差异,甚至可以说背道而驰。
研究团队以此为线索进一步分析,发现在二甲双胍处理后,代谢重编程最显著的就是CD8+T细胞对色氨酸的代谢上升,肠上皮细胞的色氨酸代谢受到抑制;而相比正常肠上皮细胞,结直肠癌细胞对色氨酸的代谢也明显增强。
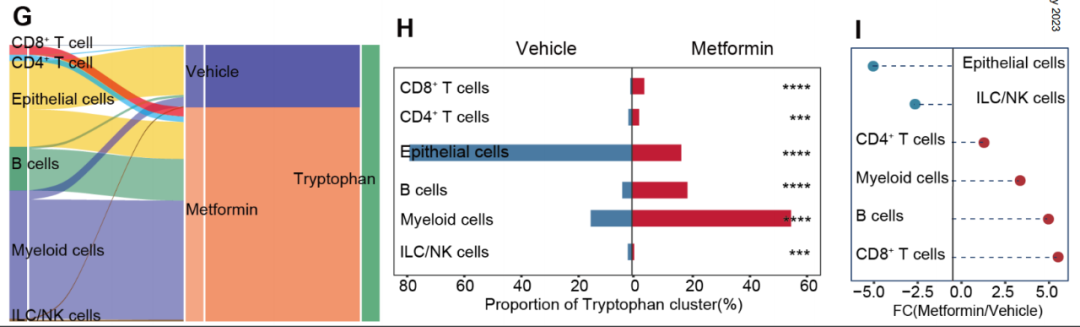
二甲双胍在正常肠道中对不同细胞色氨酸代谢的影响
看来在肠癌环境下,癌细胞和CD8+T细胞肯定会为争夺色氨酸打得不可开交,研究团队的实验也证实了该假设,并发现CD8+T细胞明显争不过癌细胞,但二甲双胍处理就能够逆转战局,帮CD8+T细胞争到更多的色氨酸。
在 外援 助力下获取更多色氨酸后,CD8+T细胞释放颗粒酶B、干扰素- (IFN- )和肿瘤坏死因子- (TNF- )的能力显著增强,意味着它们的细胞毒性被有效恢复,而且实验也证实二甲双胍的这种效应是色氨酸依赖性的。
二甲双胍是怎么帮CD8+T细胞争取到更多的色氨酸呢?研究团队分析了肠癌及正常肠道组织中色氨酸转运蛋白的mRNA表达情况,发现与正常肠道组织相比,肠癌细胞中转运蛋白SLC7A5的表达显著上调,且表达水平与肠癌患者临床分期、淋巴结及远处转移情况相关,敲除SLC7A5就可有效改善CD8+T细胞的功能。
换句话说,SLC7A5与肠癌细胞的色氨酸代谢高度相关,它也正是二甲双胍的作用目标:在二甲双胍处理后,肠癌细胞高表达的SLC7A5就显著减少;更进一步的分析显示,二甲双胍可显著下调MYC基因表达,从而减少MYC蛋白与SLC7A5基因的启动子部位结合,抑制SLC7A5基因的表达水平,进而干预色氨酸代谢。
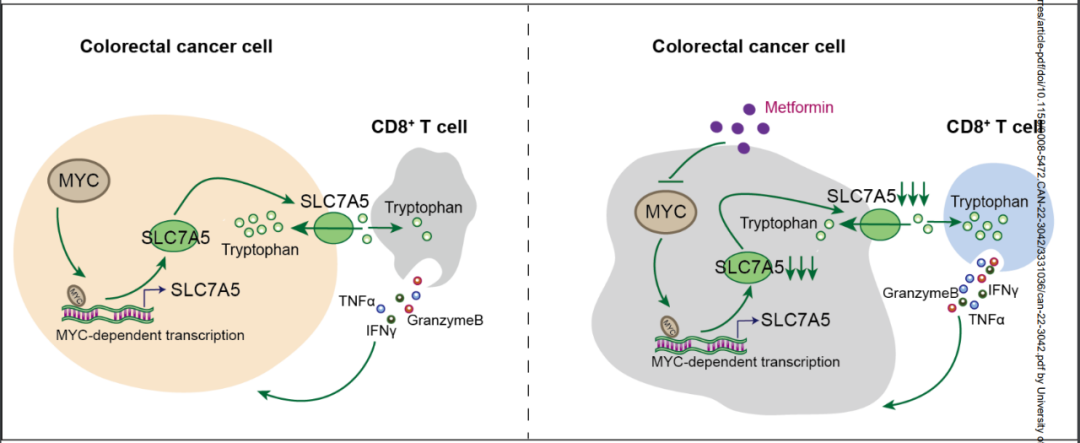
二甲双胍通过下调MYC抑制SLC7A5基因表达,影响色氨酸代谢
总而言之,仁济医院团队开展的本次研究,揭示了二甲双胍调节肠癌细胞色氨酸代谢的全新机制,进一步解释了二甲双胍重塑肠癌免疫微环境,特别是增强CD8+T细胞免疫功能的作用,至于如何更好地从色氨酸代谢入手调节抗肿瘤免疫,用好二甲双胍这款老牌 神药 ,就期待研究成果尽快向临床实践转化吧。
参考文献:
[1]Higurashi T, Hosono K, Takahashi H, et al. Metformin for chemoprevention of metachronous colorectal adenoma or polyps in post-polypectomy patients without diabetes: a multicentre double-blind, placebo-controlled, randomised phase 3 trial[J]. The Lancet Oncology, 2016, 17(4): 475-483.
[2]Huang X, Sun T, Wang J, et al. Metformin reprograms tryptophan metabolism to stimulate CD8+ T cell function in colorectal cancer[J]. Cancer Research, 2023: CAN-22-3042.
[3]Uehara T, Eikawa S, Nishida M, et al. Metformin induces CD11b+-cell-mediated growth inhibition of an osteosarcoma: implications for metabolic reprogramming of myeloid cells and anti-tumor effects[J]. International Immunology, 2019, 31(4): 187-198.
[4]Xiong W, Sun K Y, Zhu Y, et al. Metformin alleviates inflammation through suppressing FASN-dependent palmitoylation of Akt[J]. Cell Death Disease, 2021, 12: 934.
[5]Campesato L F, Budhu S, Tchaicha J, et al. Blockade of the AHR restricts a Treg-macrophage suppressive axis induced by L-Kynurenine[J]. Nature communications, 2020, 11: 4011.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















