Nature子刊:李大力团队开发精准高效的腺嘌呤颠换编辑器ACBE |
 |
来源:生物世界 2023-06-19 11:02
人类的遗传疾病主要由基因突变造成,并且约58%为单碱基突变(SNVs)。目前,不依赖DNA双链断裂和模板参与的单碱基编辑器(base editors)是治疗遗传病强有力的基因编辑工具。现有的碱基编辑技人类的遗传疾病主要由基因突变造成,并且约58%为单碱基突变(SNVs)。目前,不依赖DNA双链断裂和模板参与的单碱基编辑器(base editors)是治疗遗传病强有力的基因编辑工具。现有的碱基编辑技术CBE(C-to-T),CGBE(C-to-G),GBE(C-to-G/C-to-A)和ABE可实现胞嘧啶转换/颠换编辑以及腺嘌呤的转换突变,由于缺少切除肌苷的内源DNA糖苷酶,ABE的产物纯度可达99%。然而,仍有25%的人类单碱基突变遗传疾病需要的腺嘌呤颠换编辑(A-to-C或A-to-T)才能纠正,因此开发高效精准的腺嘌呤碱基编辑器具有重要意义(图1)。
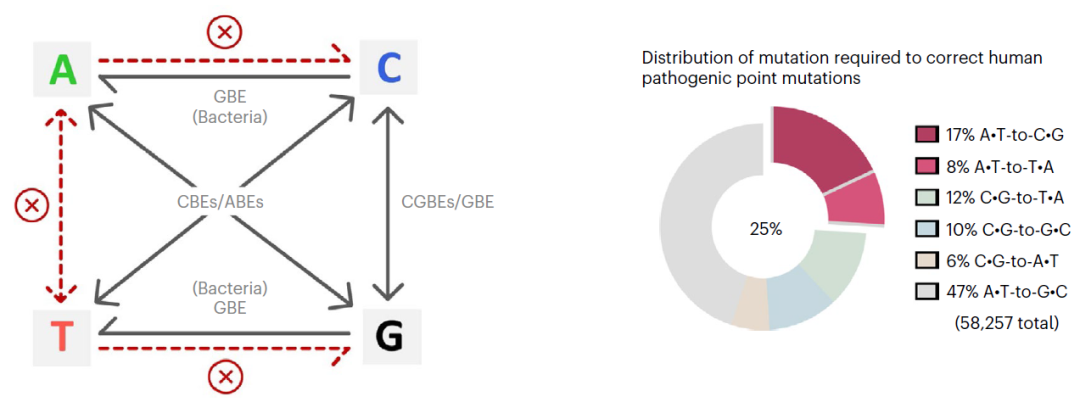
图1:碱基编辑器介导碱基突变的种类及人类致病性点突变的分布
2023年6月15日,华东师范大学李大力课题组在Nature Biotechnology期刊发表了题为:Adenine transversion editors enable precise, efficient A T-to-C G base editing in mammalian cells and embryos的研究论文。
该研究报道开发了一系列腺嘌呤颠换编辑工具(AXBEs和ACBEs),并且证明了ACBEs在不同细胞系与小鼠胚胎中的高效性与精确性,其中产生的小鼠疾病模型(A C平均效率44%-56%)等位基因突变高达100%。AXBEs和ACBEs为多元化的遗传操作和人类第二大类SNVs的基因治疗提供新的工具。

碱基转换可通过碱基脱氨实现,而碱基颠换则需要依赖无嘌呤无嘧啶(AP)位点的创建,随后进行碱基切除修复途径(BER)而完成。鉴于内源糖苷酶低效的肌苷切除修复能力,华东师大研究人员希望寻找其他可将肌苷作为催化底物的酶,在大多数原核和真核生物中,DNA中的次黄嘌呤是由烷基腺嘌呤DNA糖基化酶或者核酸内切酶V去除,因此研究人员尝试将9种体外具有潜在肌苷切除活性的酶与腺苷脱氨酶TadA-8e和nCas9融合,结果惊喜的发现小鼠来源的烷基腺苷DNA糖苷酶(mAAG)可实现8.7%的A到Y(Y=C或T)的碱基颠换,并且大鼠、枯草芽孢杆菌来源的融合构建体也可观察到一定的腺嘌呤颠换突变。进一步的位置关系测试发现mAAG位于构建体C端的编辑活性最高,因此将其命名为AXBE(X代表任意碱基)。
经过大量内源性靶点评价以及体外酶活实验发现AXBE具有YA*R(R=A或G)motif的偏好性。在含有YAR motif的靶点中,AXBE可产生15-32%的A到Y碱基颠换编辑。AXBE在HeLa细胞系中也可达到高达46%的腺嘌呤碱基颠换。通过Cas9依赖性/非依赖性脱靶评估以及RNA-seq脱靶检测发现,相比于ABE系统,AXBE的脱靶明显降低,尤其是在RNA水平上降低了90%。
为增加腺嘌呤颠换编辑效率并拓展靶向范围,基于结构导向的理性设计和筛选鉴定出mAAG中的两个关键突变(mAAG-EF)极大提高其底物肌苷的切除活性,基于此产生的AXBEv2介导更高效的A到Y编辑,甚至在非YAR-motif位点的颠换突变也显著提升,因此有效改善了颠换编辑的序列背景选择性。此外,mAAG-EF也可以兼容PAM识别更广的其他Cas9变体(如spNG,spRY),表明了更大范围的基因组靶向编辑。
虽然AXBEv2展现了高效的A C/T编辑能力(C为主产物),但也诱导了严重的旁观者A to G突变,于是研究人员希望通过缩窄编辑窗口减少不想要的编辑副产物从而开发出ACBEs技术。腺嘌呤脱氨酶的改造及Cas9嵌入策略的尝试使得A到G的编辑副产物大幅降低,并且A到C的编辑效率还进一步提高,因此该类型编辑器被命名为ACBEs。ACBE版本最高可实现45%的A到C编辑以及73%的碱基颠换编辑,而ACBE-Q版本(TadA-8e中引入N108Q突变)相较于ACBE,进一步显著减少了旁观者A到G突变,更加精准地编辑sgRNA的A4-A6位,精确度最高提高了171倍,且产生背景水平的Cas9非依赖性脱靶事件(平均脱靶效率 0.3%),展现出较高的应用安全性。
近期Nature Biotechnology报道了杨辉/胥春龙团队合作开发的腺嘌呤颠换编辑器AYBEs(),即在ABE8e基础上融合改造的人源N-甲基嘌呤DNA糖基化酶(hAAG)。
在这项最新研究中,AXBEv2表现出与AYBEv3相似的腺嘌呤颠换活性同时伴随着旁观者A to G的突变,但相较于AXBEs和AYBEs,ACBE-Q却能在保持A到C编辑活性的前提下,产生更少的旁观者A to G编辑。
此外,ACBE-Q在小鼠体内也展现出极高的编辑效率和精度。在构建杜氏肌营养不良(DMD)小鼠疾病模型中,70%突变小鼠(21/30只)实现了靶位点A6 to C的编辑,平均编辑效率为56%,A to C编辑纯度最高可达到99.8%。
更重要的是, 传统的终止密码子产生只能依赖于胞嘧啶的突变,该研究证明了ACBEs可在富含AT的序列背景中基于腺嘌呤引入提前成熟的终止子,通过终止Tyr基因表达成功制备了小鼠白化病模型。最后研究人员评估了ACBEs编辑人类致病性SNVs位点的能力,结果表明ACBE在SH3TC2基因中有效产生63%的终止密码子,该基因的终止会导致腓骨肌萎缩症疾病,通过靶向MYO7A基因,ACBE精准产生与耳聋有关的L618R错义突变。
为了研究ACBEs的治疗潜力,研究者构建了携带STAT3c.1145G T(该热点突变引起复发性传染病)突变的稳转细胞系,ACBEs可以在目标位置引入了想要的A to C纠正编辑(图2)。
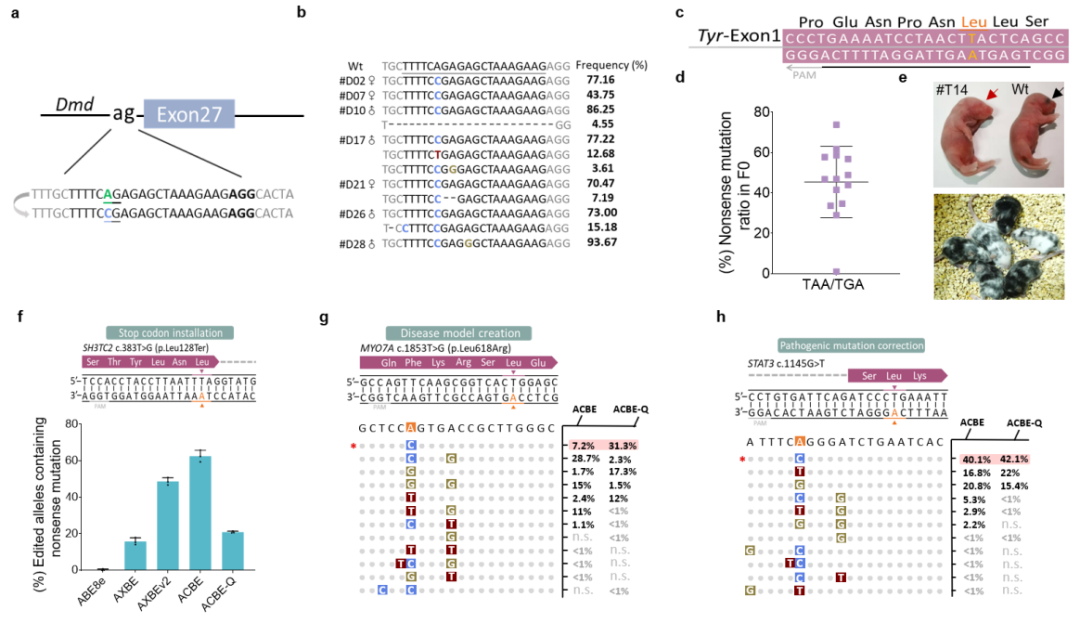
图2:ACBEs在小鼠体内精确编辑以及在细胞系中模拟或纠正人类致病SNVs
总的来说,该研究通过筛选发现小鼠来源的烷基腺苷DNA糖苷酶(mAAG)产生的腺嘌呤颠换编辑器AXBE可在特定序列中实现腺嘌呤的颠换,进一步的分子进化使得A Y编辑最高可达73%。AXBEs带来丰富的密码子和氨基酸改变,未来将更适用于分子进化、遗传筛选、谱系示踪等应用。ACBEs能够在AT富集区域提前引入终止密码子扩大了基因调控的范围,并且mAAG与不同Cas变体的兼容性有望进一步扩大了A到C的靶向范围,表明了纠正人类第二大类致病性SNVs的治疗前景,另外ACBEs还可以作为独特的工具来探索与胸腺嘧啶相对的特定AP位点如何修复的机制。
华东师范大学生命科学学院博士毕业生陈亮、博士研究生洪梦佳和栾昌明为论文共同第一作者,华东师范大学为第一单位,华东师范大学李大力教授为论文通讯作者。麻省理工学院-哈佛大学博德研究所David Liu教授团队,华东师范大学/邦耀生物刘明耀教授、宋高洁教授、香港中文大学冯波教授等对该研究提供了重要支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 《自然·衰老》:又发现近300种蛋白与阿尔茨海默病相关,7蛋白模型预测AD状态AUC最高可达0.88! (2025-06-07)
- 刷新记录!瑞康曲妥珠单抗获批治疗HER2突变非小细胞肺癌,中国患者迎来高效低毒新疗法 (2025-06-07)
- 你是一喝酒就脸红吗?多项研究:喝酒脸红者更易衰老、出现大脑中Aβ病理加重、炎症因子分泌减少等问题,增加阿尔茨海默病发生风险 (2025-06-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















