单细胞多组学技术揭示三维基因组与基因表达的关系 |
 |
来源:北大 2023-06-21 11:25
在高等真核生物中,基因组在细胞核内的三维空间构象对细胞功能至关重要。例如,增强子常常通过三维空间相互作用对远端目的基因的转录活性起调控作用在高等真核生物中,基因组在细胞核内的三维空间构象对细胞功能至关重要。例如,增强子常常通过三维空间相互作用对远端目的基因的转录活性起调控作用1-3。三维基因组水平上的异常也被发现与包括癌症在内的多种疾病的发生密切相关4-6。然而,三维基因组与基因表达的整体关系仍然存在争议。例如,通过靶向降解染色质空间构象的关键调控蛋白CTCF或cohesin,可以使基因组空间构象发生重大重排,但对基因表达却只造成了较微弱的影响7-9。在果蝇胚胎中,不同细胞类型间的基因表达具有显著差异,但染色质结构差别并不明显10,11。因此,想要进一步认识复杂组织器官和丰富细胞类型背景下的染色质三维结构和基因表达之间的关系,亟需更有力的工具。
北京大学生物医学前沿创新中心(BIOPIC)邢栋课题组在Science期刊发表了题为的研究论文,报道了一种新型单细胞多组学技术HiRES(Hi-C and RNA-seq employed simultaneously),首次基于测序方法实现了在单细胞水平对转录组和三维基因组的同时检测。
HiRES方法在细胞群体水平进行原位反转录和染色质构象捕获(3C),之后通过流式分选得到单细胞,再对每个单细胞进行扩增后测序(图1A)。DNA或RNA读段通过反转录过程中引入的RNA识别序列进行区分,因此该方法不涉及DNA和RNA的物理分离,最大程度地提高了检测效率。在小鼠大脑样品中,平均每个细胞可以检测到6517个基因,27,468条转录本(UMIs)以及317,435个染色质相互作用(图1B、C)。利用该数据,研究人员可以对单细胞三维基因组进行高分辨率结构重构,并可以在三维结构上对基因表达水平进行观测(图1D、E)。
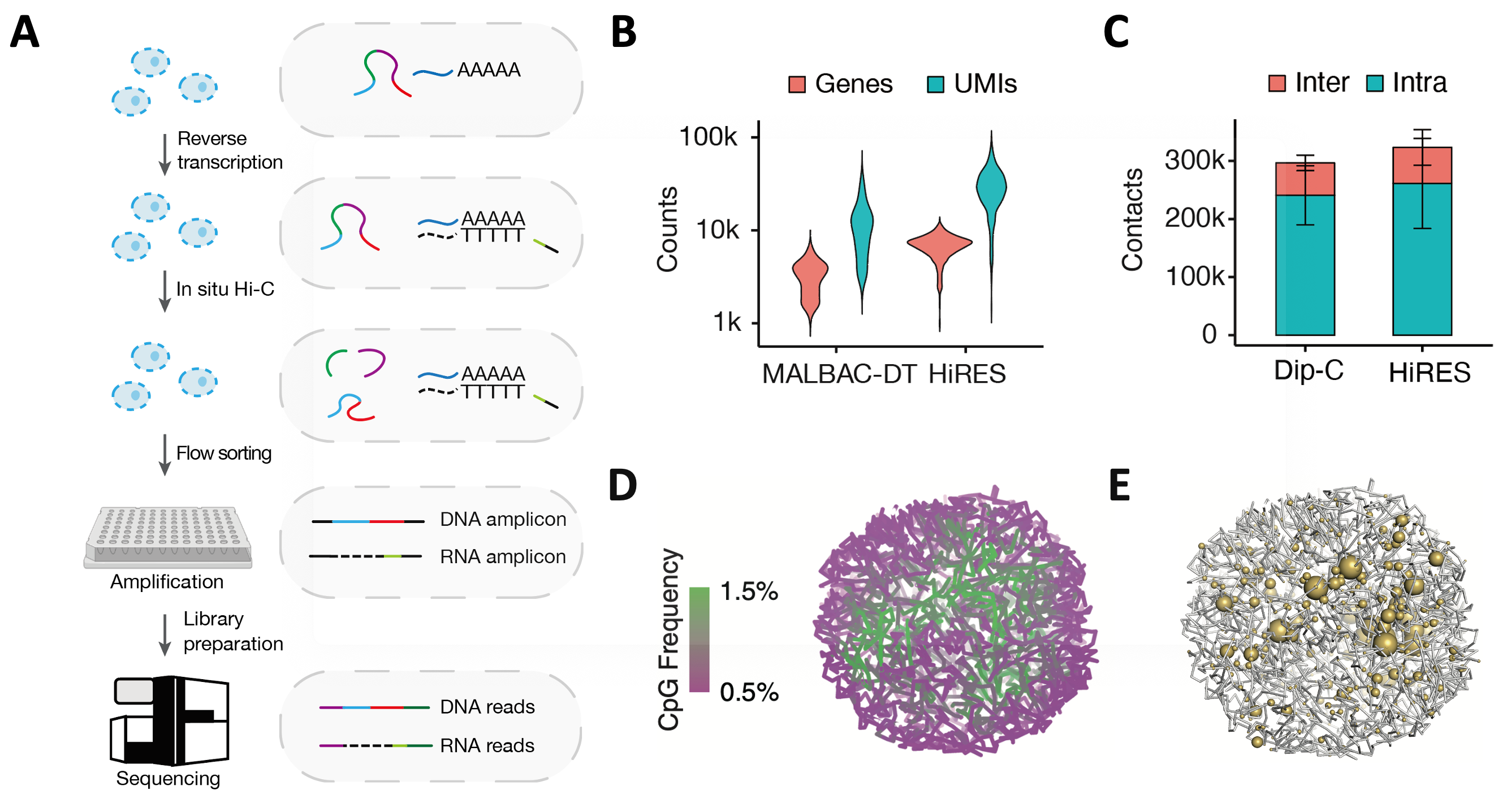
图1 HiRES方法能高效检测单细胞的转录组和三维基因组(A)HiRES方法流程示意图。(B)MALBAC-DT和HiRES两种方法检测到的基因和转录本数目。(C)Dip-C和HiRES两种方法检测到的染色质相互作用数。(D)示例单细胞染色质三维结构上的染色质区室化情况,可以看到异染色质(洋红色)和常染色质(绿色)的分区。(E)示例单细胞染色质三维结构上的基因表达情况。球的大小代表表达量的高低
之后,利用HiRES方法,研究人员绘制了小鼠胚胎自妊娠后7天至11.5天这一时期共7469个单细胞的转录组和三维基因组图谱。通过对该双组学数据的分析,该研究在以下几个方面进行了探索:
一、不同细胞类型中细胞周期对三维基因组的影响
胚胎发育时期的细胞处在快速增殖的过程中,细胞周期对三维基因组的影响不容忽视。该研究利用HiRES的双模态数据,开发了一种对单细胞进行细胞周期划分的策略。该策略主要依赖DNA空间相互作用特征、细胞周期相关基因表达以及DNA复制程度等指标,可以将单细胞分配到不同的细胞周期状态之一(图2)。
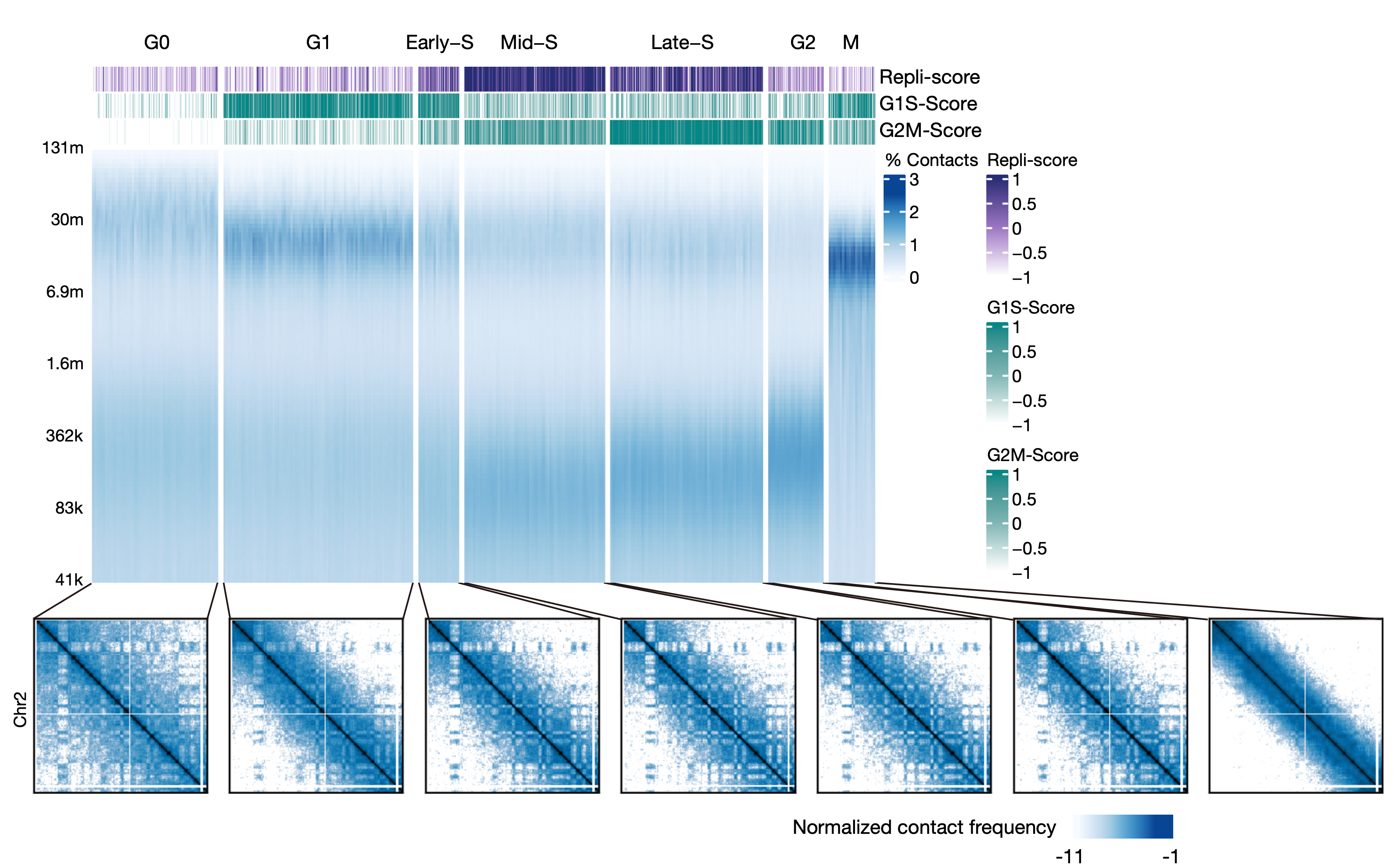
图2 利用双组学特征注释细胞周期状态。图中每一列为一个单细胞
在胚胎组织中,研究人员发现根据染色质结构定义的细胞类群与细胞周期状态之间的一致性更强,说明与细胞周期相关的染色质结构变化对总体的染色质空间构象具有重要影响。在不同的细胞类型之间,该研究开发了一种半定量的比较细胞周期过程中染色质结构的方法,并发现分裂间期细胞的染色质构象由两个独立的过程决定 有丝分裂后染色体的自发展开和基因组的复制。对于G1期较短的细胞类型,这两个过程在时间上可能重叠,从而共同决定了染色质三维结构的细胞周期动态。
二、不同细胞类型间的差异染色质相互作用与细胞功能密切相关
研究不同细胞类型的染色质结构差异是三维基因组研究的重要问题之一。利用Hi-C技术寻找差异染色质相互作用常常面临数据的稀疏性、高噪音和较少的生物学重复等困难。针对这些问题,该了Simple Diff策略,通过对两组重构的单细胞全基因组三维结构中两点之间的空间距离进行非参检验的方式,可以高效检测染色质差异相互作用(differential interaction,DI)。基于该方法,研究人员发现染色质结构的特化在原肠形成时期就已经出现,并且差异染色质结构位点上显著富集了差异表达基因,提示染色质结构变化与细胞功能紧密相关。
在此基础上,该研究进一步利用染色质相互作用强度与基因表达水平的协同变化,将差异相互作用与其潜在的相关基因联系起来,并将这些与基因表达显著相关的差异相互作用称为GADI(gene-associated DI)。研究发现GADI常常将启动子与远端的调控元件(如增强子、超级增强子)连接起来(图3)。因此,GADI不仅仅是转录活动的结果,还包含了许多潜在的增强子-启动子相互作用,这些相互作用很可能是控制细胞类型特异性基因表达的基础。

图3 连接到Dcc和Dlc1基因的GADI示例
三、发现广泛存在的先于基因转录激活的染色质结构重排
在将染色质相互作用与特定基因联系起来后,该研究进一步比较了染色质构象变化和转录水平变化在拟时间序列上的先后关系,并鉴定了超过4万个先于转录变化的染色质相互作用变化。通过对这些染色质空间构象变化位点的表观遗传学分析,发现这种先于转录的染色质构象变化主要分为两类:首先,在大多数基因位点上,先于基因表达的染色质构象重排主要建立在活性染色质之间,这可能是增强子的激活所驱动的;其次,对于一部分位于抑制性染色质环境中的基因,转录激活前需要出现异染色质结构的松弛(图4)。尽管这两种过程背后更详细的分子机制有待进一步探索,这一结果强烈地支持了染色质三维结构广泛参与基因表达调控的观点。
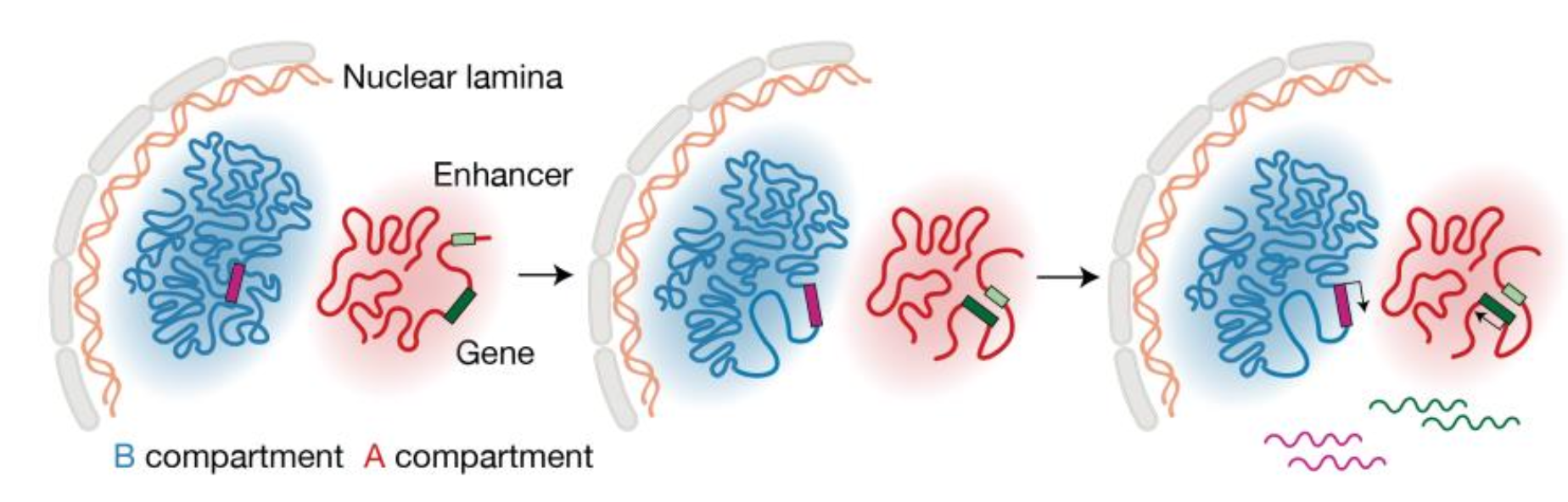
图4 转录激活前发生的染色质结构重构的示意图
北京大学生物医学前沿创新中心、生命科学学院博士生刘致远、陈玉洁、夏启旻为该论文的共同第一作者,邢栋为该论文通讯作者。该研究得到了科技部、国家、北京大学"临床医学+X-青年学者项目"和北京未来基因高精尖创新中心的资助,以及北京大学高通量测序平台的协助与支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 《自然·衰老》:又发现近300种蛋白与阿尔茨海默病相关,7蛋白模型预测AD状态AUC最高可达0.88! (2025-06-07)
- 刷新记录!瑞康曲妥珠单抗获批治疗HER2突变非小细胞肺癌,中国患者迎来高效低毒新疗法 (2025-06-07)
- 你是一喝酒就脸红吗?多项研究:喝酒脸红者更易衰老、出现大脑中Aβ病理加重、炎症因子分泌减少等问题,增加阿尔茨海默病发生风险 (2025-06-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















