《自然》:亚油酸或有益于肠道免疫!哈佛和中科院大学合作发现,肠道菌转化产生的共轭亚油酸可诱导一种特定类型的抵抗病原体的免疫细胞 |
 |
《自然》:亚油酸或有益于肠道免疫!哈佛和中科院大学合作发现,肠道菌转化产生的共轭亚油酸可诱导一种特定类型的抵抗病原体的免疫细胞
来源:奇点糕 2023-07-24 10:26
,这项研究揭示了一个新的肠道微生物调控免疫的机制,有助于帮助肠道抵抗病原菌感染。Kasper教授指出,饮食-微生物-免疫系统三者相互作用的更多例子尚未被揭示的原因之一就是这些途径非常复杂,但是通过研究You are what you eat.
这句话大家一定不陌生,食物对我们身体的影响太大了,尤其是肠道微生物研究兴起后,大家对这句话的认识想必又更加深入了一些。近年来,揭示饮食如何通过肠道微生物调节细胞、组织和器官功能的研究层出不穷,其中系统更是备受关注。
最近,《自然》杂志上刊登了一项新的研究[1],研究发现,亚油酸这种常见脂肪酸在被摄入体内后,经由肠道微生物转化为共轭亚油酸,它是诱导小肠中产生一种特定类型的免疫细胞 CD4+CD8 +上皮内淋巴细胞所必需的,研究还揭示了具体的诱导机制,并且在小鼠中证实,如果缺乏这类细胞,会加剧肠道病原菌感染,例如伤寒沙门氏菌。
这项研究的通讯作者为哈佛医学院的Dennis Kasper教授和中国科学院大学的宋昕阳研究员。

这项研究开始于研究人员观察到的一个现象:实验室中饲养的无菌小鼠缺少CD4+CD8 +上皮内淋巴细胞(IEL),这类特殊的免疫细胞位于小肠粘膜上皮,由经典CD4+T细胞或调节性T细胞下调转录因子ThPOK分化而来[2-4],同时具有细胞毒性和调节特性,并被认为对饮食耐受性具有重要作用[2,3]。
不但如此,饲喂生存必需营养成分组成的最低限度饮食的小鼠也比较缺乏CD4+CD8 +IEL,只有成分丰富的正常饮食饲喂的小鼠才有一般水平的CD4+CD8 +IEL,而且饮食差异导致的CD4+CD8 +IEL水平差异局限在小肠(十二指肠、空肠和回肠)中。这让研究人员怀疑,饮食和肠道微生物之间的相互作用可能是决定CD4+CD8 +IEL水平的关键。
小肠是通过肠肝循环吸收脂肪酸的活跃部位,最低限度饮食中,多种短链和长链脂肪酸的水平确实也明显不足,因此,研究人员进行了逐一测试,结果只有长链脂肪酸 共轭亚油酸(CLA)的混合物(9-顺式,11-反式CLA和10-反式,12-顺式CLA 1:1)将最低限度饮食小鼠回肠中CD4+CD8 +IEL提高到与正常饮食小鼠相近的水平。
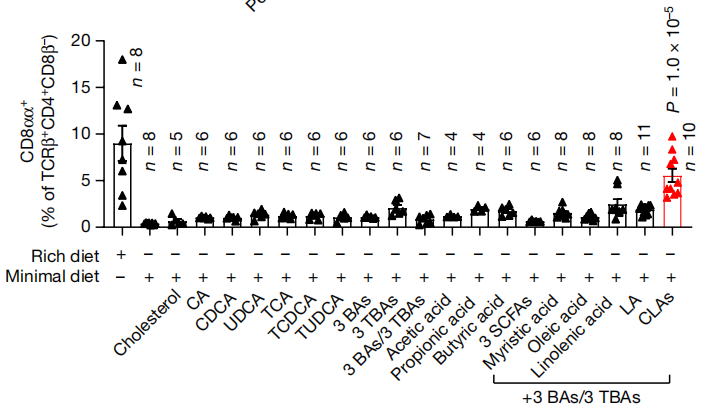
补充CLA混合物可以显著提高CD4+CD8 +IEL水平
CLA是亚油酸的异构体,一些肠道细菌可以通过亚油酸异构酶(LAI)将亚油酸转化为CLA,例如肠球菌、乳酸杆菌、双歧杆菌、瘤胃球菌和毛螺菌。在最低限度饮食喂养过程中,这些携带LAI的肠道细菌丰度逐渐降低。在LAI-和LAI+肠菌定植小鼠中,只有LAI+小鼠在正常饮食后诱导产生了较高水平的CD4+CD8 +IEL。
接下来就是透过现象看本质,携带LAI的肠道菌群将饮食摄入的亚油酸转化为CLA后,是如何诱导产生CD4+CD8 +IEL的呢?
研究人员注意到,CD4+CD8 +IEL选择性地表达两种核受体,HNF4 和HNF4 ,它们都是肠上皮细胞中脂肪酸代谢的关键调控因子。
两相对比,HNF4 在整个胃肠道中均有高表达,HNF4 则主要在小肠中表达,而且HNF4 只调节自然IEL,不影响回肠CD4+CD8 +IEL水平。
HNF4 就不一样了,Hnf4g缺陷型小鼠的CD4+IEL中,ThPOK水平明显增加,将Hnf4g缺陷型小鼠的幼稚CD4+T细胞转移给对照组小鼠后,对照组小鼠的回肠CD4+CD8 +IEL水平与Hnf4g缺陷型小鼠和最低限度饮食饲喂小鼠相似。补充CLA能够恢复最低限度饮食饲喂小鼠的回肠CD4+CD8 +IEL水平,但Hnf4g缺陷型小鼠不行。
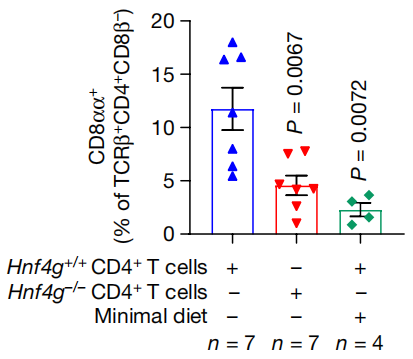
对照组小鼠、Hnf4g缺陷型小鼠和最低限度饮食饲喂小鼠的回肠CD4+CD8 +IEL水平
由此可见,CLA-HNF4 轴是调节CD4+CD8 +IEL水平所必需的。
转录组分析显示,CD4+CD8 +IEL高表达Il13ra1和Il18r1,而Il18缺陷型小鼠中,回肠CD4+CD8 +IEL水平显著降低,这表明,白介素-18(IL-18)信号可能在诱导产生CD4+CD8 +IEL中发挥重要作用。
HNF4 缺陷或最低限度饮食不影响回肠IL-18水平,但HNF4 可以与CD4+IEL中Il18r1(编码IL-18受体1)的转录起始位点结合,最低限度饮食还可以导致CD4+IEL表面IL-18R1的表达受损。基于此,通过一系列饲喂对照实验,研究人员确定了,HNF4 可以通过IL-18受体下调ThPOK,从而诱导CD4+CD8 +IEL的产生。
由此我们可以得出一条清晰的路线,在摄入包含亚油酸的饮食后,含LAI的肠道菌群能够将亚油酸转化为CLA,CLA与核受体HNF4 结合,CD4+IEL产生IL-18R,下调ThPOK,诱导它们分化为CD4+CD8 +IEL。
CD4+CD8 +IEL可以维持肠道稳态,表达抗感染和屏障修复功能的特征基因,因此,研究人员在小鼠中验证了CLA-HNF4 级联是否能够调节鼠伤寒沙门氏菌(STm)感染的肠道炎症反应。
饲喂实验显示,仅喂食最低限度饮食小鼠出现严重的肠上皮损伤,高水平的血清炎症细胞因子,细菌向非肠道器官传播增加,死亡率显著升高,而补充CLA能够显著增加它们的回肠CD4+CD8 +IEL水平和对STm感染的抵抗能力。
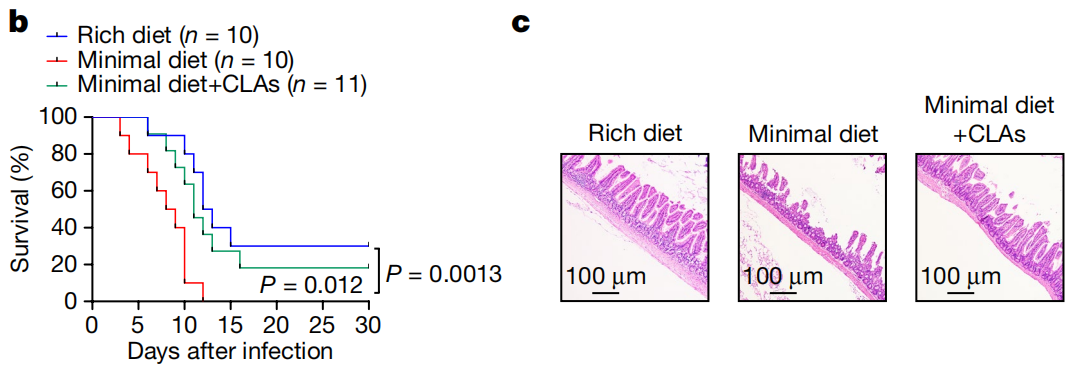
正常营养丰富饮食(蓝)、最低限度饮食(红)和最低限度饮食+补充CLA(绿)小鼠在感染后的生存率变化和第5天时的回肠组织学
总的来说,这项研究揭示了一个新的肠道微生物调控免疫的机制,有助于帮助肠道抵抗病原菌感染。Kasper教授指出,饮食-微生物-免疫系统三者相互作用的更多例子尚未被揭示的原因之一就是这些途径非常复杂,但是通过研究这些复杂的途径,科学家们能够更好地了解微生物组如何帮助人体保持健康,以及如何在缺乏时进行干预。
参考文献:
[1] Song, X., Zhang, H., Zhang, Y. et al. Gut microbial fatty acid isomerization modulates intraepithelial T cells. Nature (2023). https://doi.org/10.1038/s41586-023-06265-4
[2] Mucida D, Husain M M, Muroi S, et al. Transcriptional reprogramming of mature CD4+ helper T cells generates distinct MHC class II restricted cytotoxic T lymphocytes[J]. Nature immunology, 2013, 14(3): 281-289.
[3] Sujino T, London M, Hoytema van Konijnenburg D P, et al. Tissue adaptation of regulatory and intraepithelial CD4+ T cells controls gut inflammation[J]. Science, 2016, 352(6293): 1581-1586.
[4] Bilate A M, Bousbaine D, Mesin L, et al. Tissue-specific emergence of regulatory and intraepithelial T cells from a clonal T cell precursor[J]. Science immunology, 2016, 1(2): eaaf7471-eaaf7471.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:李芝倩等编辑 “隐形基因开关” 使蚊子不再传播疟疾 (2025-08-04)
- 人类也拥有冬眠“超能力”?《科学》背靠背揭开冬眠秘密,或有助于多种疾病治疗 (2025-08-04)
- 8.5亿美元BD交易背后,乐普生物的“成长密码” (2025-08-04)
- GSK 2025H1:肿瘤业务收入大涨,HIV业务保持强势,公司2031年目标锁定400亿+英镑 (2025-08-04)
- Cell:演化的“加速器”,癌症的“催化剂” 揭秘转录因子一体两面的遗传功能 (2025-08-04)
- AI智能体登上Nature子刊!华大智造发布靶向测序引物设计工具PrimeGen (2025-08-04)
- 《柳叶刀》子刊:日行七千步,有八大好处!迄今最大规模/最全面研究发现,日行七千步与八种健康风险最高降低47%相关 (2025-08-04)
- 《循环》:多起/坐,降血压!临床研究结果显示,增加站-坐转换次数、改善久坐行为,可有效降低绝经后女性血压 (2025-08-04)
- Nature:徐墨/高璞合作揭示过敏原诱导免疫应答的共通分子机制 (2025-08-04)
- 四部分发文规范“自媒体”医疗科普信息宣布传达行动 (2025-08-04)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















