研究解析痕迹型恐惧关联学习的神经机制 |
 |
现实生活中,人们时常需要将前后间隔发生的事件进行关联,形成联合型情景记忆。记忆形成后,人们可以根据先前信息去预测后续事件发生,从而及时做出行为反应。在神经科学研究中,研究常用痕迹型条件恐惧行为范式(Trace fear conditioning,TFC)来探究这种不连续事件关联学习的神经机制。TFC不同于经典的巴甫洛夫延迟型条件恐惧行为范式(Delay fear conditioning,DFC)。在DFC中,条件性刺激CS(如声音)和非条件性反射刺激US(如疼痛电击)之间没有时间间隔。而在TFC恐惧行为范式中,CS与US之间存在一段几秒到几十秒的时间间隔。这段时间间隔被称为痕迹(trace)。痕迹越长,关联学习的难度越大。TFC与DFC相比,需要涉及更多的高级认知功能如工作记忆和时间表征等,故它的神经机制更加复杂。基于TFC逻辑的行为范式常用于神经退行性疾病的认知测试以及情绪异常的精神疾病研究,因而探索其背后的神经机制对相关领域的理解和应用具有重要的参考作用。
徐春研究组利用神经环路示踪和光遗传行为学等方法,发现光遗传学抑制CA1投射到Sub的神经末梢可以阻碍CS与US的关联学习(图1A-B),确定了CA1到下托Sub的神经环路对TFC成功学习有至关重要作用。该团队运用自由移动头戴式钙成像(miniscope Ca2+ imaging)技术,分别在CA1和Sub脑区全程记录了兴奋性神经元在TFC行为训练当中的神经活动。研究发现,CA1和Sub的神经元在CS结束后均有延续性的神经活动,这可能是海马脑区维持短时记忆信息的基本表现特征(图1C-D)。CA1和Sub神经元展现出如下几方面的神经可塑性:(1)CA1和Sub脑区中对CS和trace有明显反应的神经元数量随着学习进行而增加。其中,CA1神经元的活跃比例还与恐惧记忆形成的强度呈现正相关性(图1E-F)。(2)CA1的神经元在trace阶段的群体活动特征逐步变得与CS阶段的群体活动特征相似(图1G),表明trace阶段的CS信息维持得到了提高。(3)随着TFC学习的进行,CA1和Sub神经元在trace阶段的最高活动时间点逐渐向后延迟,向US发生时间点靠近。这将有助于CS信息与US形成关联记忆(图1H)。
非条件刺激US是学习过程中形成关联学习的强化因子。研究发现,CA1脑区的US反应细胞的数量随着学习逐步增加,并与恐惧记忆形成的强弱相关。而这一现象在Sub脑区的US反应细胞中不存在,说明CA1细胞参与了US信息的编码和记忆储存。究其原因,CA1脑区中对US刺激表现出稳定反应的神经元多于Sub,这可能是CA1深度参与US相关的恐惧记忆的深层原因。
研究表明,CA1-Sub环路对不连续事件的关联学习具有重要作用。CA1和Sub神经元在外界刺激信息结束后均具有一定的信息维持能力。这种信息维持能力在学习过程中可被逐步加强、持续更久。与Sub神经元相比,CA1神经元对恐惧记忆的储存起到更大的贡献作用。这揭示了海马脑区在不连续事件关联学习中的重要作用和神经环路机制,丰富了学习与记忆研究的生物学基础理论。
研究工作得到科学技术部、国家委员会、中国科学院、上海市和临港实验室的支持。
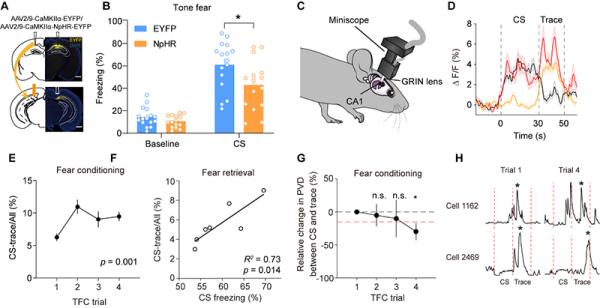
图1. CA1-Sub环路参与痕迹型恐惧关联学习。(A-B)光遗传学抑制CA1-Sub环路阻碍CS与US的关联学习。(C-D)利用头戴式钙成像显微镜,在自由移动动物中发现海马神经元在CS和trace阶段均展现出显著的神经活动。(E-F)CA1脑区中对CS和Trace都有反应的神经元在学习过程中比例增加,并与形成的记忆强度成正相关。(G)CA1神经元在trace阶段的神经活动与CS阶段神经元活动在编码空间上的距离随着学习变得相近。(H)神经元在trace阶段的最高活动时间点随着学习逐步后移。
医药网新闻
- 相关报道
-
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 《自然·衰老》:又发现近300种蛋白与阿尔茨海默病相关,7蛋白模型预测AD状态AUC最高可达0.88! (2025-06-07)
- 刷新记录!瑞康曲妥珠单抗获批治疗HER2突变非小细胞肺癌,中国患者迎来高效低毒新疗法 (2025-06-07)
- 你是一喝酒就脸红吗?多项研究:喝酒脸红者更易衰老、出现大脑中Aβ病理加重、炎症因子分泌减少等问题,增加阿尔茨海默病发生风险 (2025-06-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















