精神分裂症新药ulotaront两项III期研究未达到主要终点 |
 |
来源:医药魔方 2023-08-01 15:39
7月31日,住友制药和大冢制药共同宣布,其在研ulotaront(SEP-363856)治疗急性精神分裂症的两项III期DIAMOND 1和DIAMOND 2研究未达到主要研究终点。7月31日,住友制药和大冢制药共同宣布,其在研ulotaront(SEP-363856)治疗急性精神分裂症的两项III期DIAMOND 1和DIAMOND 2研究未达到主要研究终点。

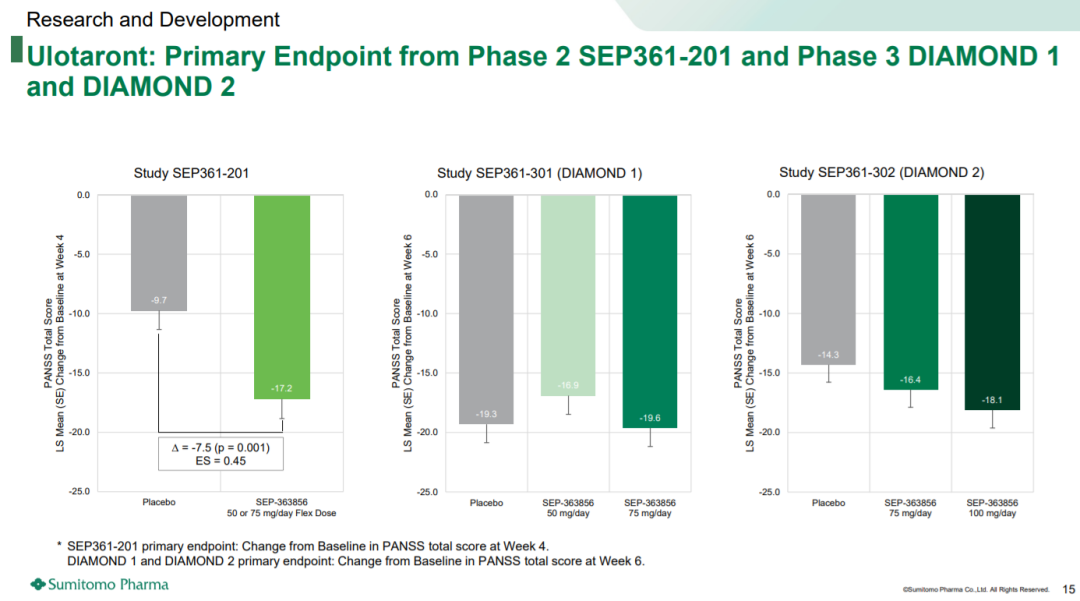
DIAMOND 1研究是一项随机、双盲、平行分组、固定剂量的多中心III期临床,旨在急性精神分裂症成人患者中评估ulotaront (50mg/天和75mg/天)与安慰剂的疗效、安全性和耐受性,为期6周,共纳入435名受试者。
结果显示,3组患者的阳性和阴性症状量表()评分均随时间的推移而降低,但在第6周PANSS评分与基线变化的主要终点上,两组均不优于安慰剂(LS均值:ulotaront 50mg/d和75mg/d治疗组分别为-16.9和-19.6,而安慰剂组为-19.3)。
DIAMOND 2研究是一项随机、双盲、平行分、固定剂量的多中心III期临床,旨在急性精神分裂症成人患者中评估ulotaront (75mg/d和100mg/d)与安慰剂的疗效、安全性和耐受性,为期6周,共纳入464名受试者。
结果显示,与安慰剂相比,ulotaront 75mg/d和100mg/d治疗组在主要终点上没有得到具有学意义的改善。第6周时,与安慰剂相比,两组ulotaront治疗组的PANSS评分从基线下降的数值更大(ulotaront 75mg/d和100mg/d治疗组的LS均值分别为-16.4和-18.1,而安慰剂组为-14.3)。
 在DIAMOND 1和DIAMOND 2研究中,观察到了很强的安慰剂效应,这可能掩盖了ulotaront 的治疗效果。此外,在两项研究中,ulotaront总体上是安全且耐受性良好的。
在DIAMOND 1和DIAMOND 2研究中,观察到了很强的安慰剂效应,这可能掩盖了ulotaront 的治疗效果。此外,在两项研究中,ulotaront总体上是安全且耐受性良好的。
Ulotaront是微量胺相关受体1(TAAR1)和5-羟色胺1A型(5-HT1A)受体双重激动剂,目前正在开展精神分裂症、广泛性焦虑障碍、重度抑郁症等多项适应症的临床研究,2019年5月其治疗精神分裂症获突破性疗法认定。
TAAR是一种G蛋白偶联受体,分布在全身各处,不仅可以被为微量胺激活,也可以被多巴胺或血清素等单胺类物质激活,其中TAAR1是大脑中分布最为广泛的TAAR,并有相关研究显示,部分精神分裂症患者存在TAAR1基因变异。
今年5月,罗氏终止了其TAAR1激动剂ralmitaront的II期临床试验,该研究旨在评估ralmitaront相较于安慰剂用于治疗精神分裂症或分裂情感障碍阴性症状患者疗效。试验终止的原因是中期分析表明ralmitaront不太可能在该研究中达到主要终点。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 《自然·衰老》:又发现近300种蛋白与阿尔茨海默病相关,7蛋白模型预测AD状态AUC最高可达0.88! (2025-06-07)
- 刷新记录!瑞康曲妥珠单抗获批治疗HER2突变非小细胞肺癌,中国患者迎来高效低毒新疗法 (2025-06-07)
- 你是一喝酒就脸红吗?多项研究:喝酒脸红者更易衰老、出现大脑中Aβ病理加重、炎症因子分泌减少等问题,增加阿尔茨海默病发生风险 (2025-06-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















