NRCO权威综述:肺癌围术期免疫治疗正高歌猛进,当前的挑战和未来的机遇这篇文章说清楚了! |
 |
来源:奇点糕 2023-08-10 18:01
从上面的一系列问题可以看出,可手术NSCLC围术期免疫治疗的“大厦”还远未建成,天空飘着各种各样颜色的云,解决这些问题不仅需要更多的临床研究和数据,还需要先进的检测手段、常态化多学科会诊和药物可及性等最近三年,绝对是可手术非小细胞()围术期治疗的 收获季节 ,关键临床研究成果相继揭晓:2021年免疫辅助治疗的IMpower010研究率先 撞线 ,2022年免疫新辅助治疗的CheckMate-816研究双主要终点 双喜临门 ,2023年又有两项采用 夹心饼 免疫治疗模式的III期研究宣告成功。
接连不断的捷报,当然会让人对NSCLC围术期免疫治疗充满期待,但或许发展越是火热,就越需要一点 冷思考 :比如截至目前,临床研究还无法明确哪一种治疗模式才是改善患者生存、提升临床治愈率的最优解,类似的问题还有单药与联合治疗之争、不同疗效终点向总生存期(OS)获益的转化程度等等。
新生事物发展就是这样,及时看清前路才是关键。近期,欧美多国专家就在《自然评论 临床肿瘤学》上共同撰文[1],盘点了截至2023年中NSCLC围术期免疫治疗取得的进展,以及未来的机遇与挑战。太长不看?绝对后悔!

论文首页截图
NSCLC围术期不同免疫治疗模式的作用机制
1)免疫辅助治疗
可手术NSCLC在术后的复发和转移风险较高,这主要与患者体内仍残存有肉眼不可见的微转移灶有关,且由于手术创伤、应激等原因,患者术后往往会处于短暂的免疫抑制状态[2];因此在术后尽快使用免疫辅助治疗,有望逆转免疫抑制来擒住微转移灶,还有望与临床实践中长期使用的辅助化疗实现协同增效。
2)免疫新辅助治疗
相较免疫辅助治疗,学界认为免疫新辅助治疗在理论上有多重优势[2],即使不谈缩瘤降期等外科获益,在尚未切除原发肿瘤前,患者体内肿瘤新抗原数量也较多,使用免疫治疗就能更好地调动更广泛的抗应答,并有效扩增肿瘤特异性记忆T细胞,且新辅助治疗还可较早通过病理检查预估疗效。
3) 夹心饼 式免疫治疗
当前取得临床研究成功的 夹心饼 模式,均为术前免疫+化疗新辅助治疗,再配合术后为期约1年的免疫辅助治疗,从而集新辅助和辅助治疗的获益于一身,目前仍在进行中的关键临床III期研究也多为 夹心饼 式。
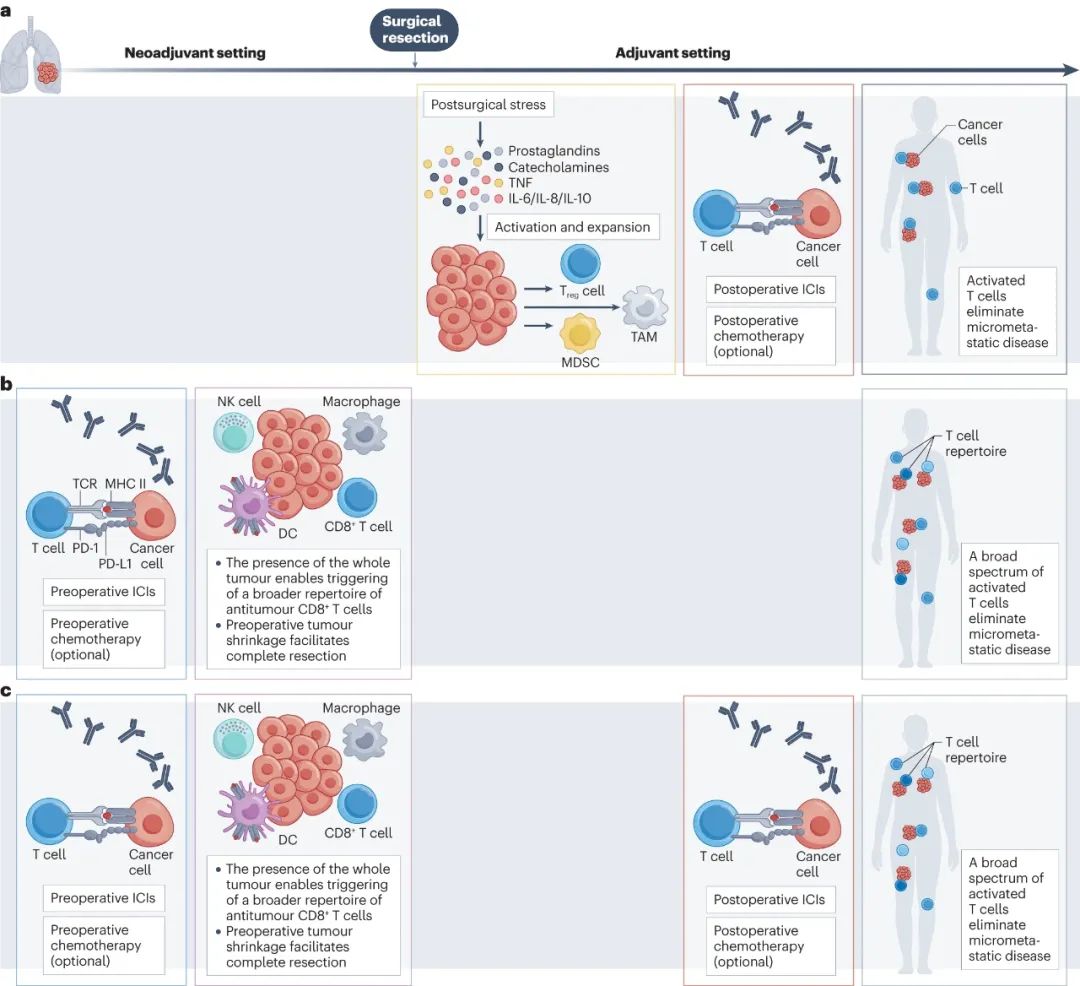
不同免疫治疗模式的作用机制示意图
免疫新辅助治疗现状
2018年登上《新英格兰医学杂志》的Checkmate-159(CA209-159)研究,首次证实免疫新辅助治疗可有效缩瘤降期,并使45%患者达到主要病理学缓解(MPR),10%达到病理学完全缓解(pCR),且初步疗效也转化为高达80%的5年生存率。
自此之后,免疫新辅助治疗就开始一路狂奔,成果亮眼的临床I/II期研究层出不穷,不过治疗方案逐步从Checkmate-159研究的免疫单药治疗,转变为MPR/pCR率更高的免疫联合治疗,其中免疫+化疗联合方案的探索进度最快。
如作为最先报告阳性结果的新辅助治疗临床III期研究,CheckMate-816研究即使用术前3个周期的纳武利尤单抗+含铂双药化疗(术后患者可接受辅助化疗/放疗/放化疗,但不同于免疫 夹心饼 模式),在pCR率(24.0%/2.2%)和中位无事件生存期(EFS,31.6个月 vs. 20.8个月)双主要终点上均达到阳性结果。
除免疫+化疗方案外,NEOSTAR、NEOpredict-Lung(纳武利尤单抗+LAG-3抑制剂Relatlimab)等研究还初步探索了双免疫方案的可行性;2023年美国临床肿瘤学会()年会上,免疫+抗联合新辅助治疗方案也正式亮相(EAST ENERGY研究),其MPR/pCR率分别为50%和33%,但副作用问题较为突出[4]。
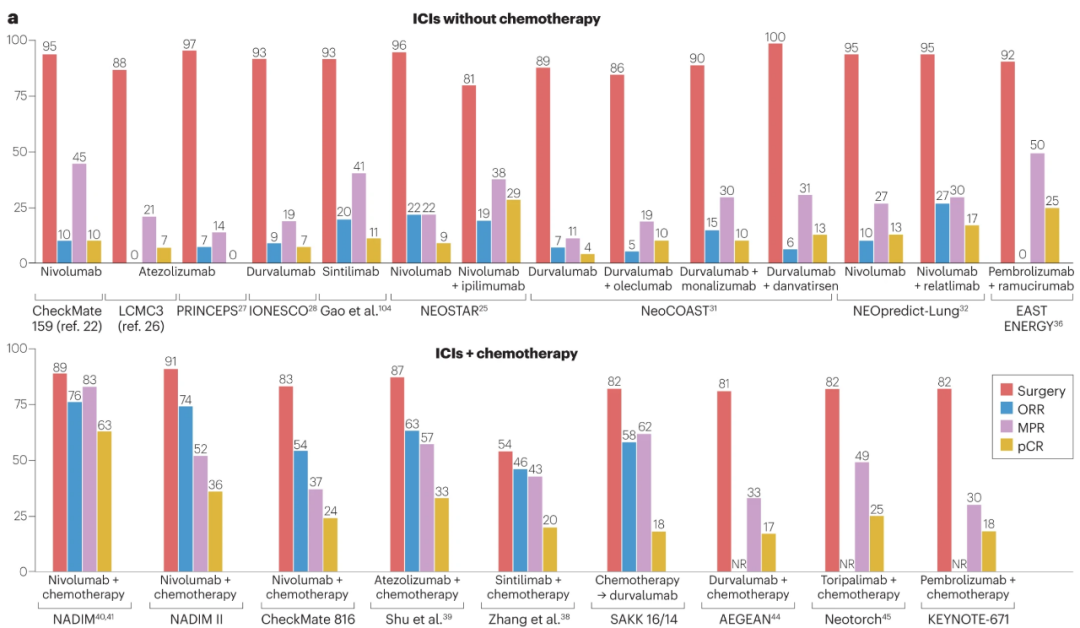
新辅助阶段免疫单药/联合治疗的疗效数据对比
免疫辅助治疗现状
免疫辅助治疗已有IMpower010、KEYNOTE-091/PEARLS两项关键临床III期研究达到无病生存期(DFS)主要终点,但两项研究的设计和疗效数据有所区别:IMpower010研究纳入患者需完成术后辅助化疗,阿替利珠单抗辅助治疗1年的方案可显著延长II-IIIA期患者中位DFS,以及PD-L1阳性II-IIIA期患者中位OS。
KEYNOTE-091/PEARLS研究的主角则是帕博利珠单抗,且不强制要求患者入组前接受辅助化疗(但实际有 85%患者接受化疗);免疫辅助治疗在全人群中达到DFS阳性结果,但却未能显著延长PD-L1高表达(TPS 50%)患者的中位DFS,这一点与IMpower010研究截然相反,也引起了学界的广泛关注和激烈讨论。
上述两项研究的亚组分析还显示,IIIA期患者可能是从免疫单药辅助治疗中获益最显著的人群,但无法更进一步阐明指导用药的患者特征或生物标志物,可能有待正在进行的BR.31、ANVIL等研究给出答案,但稍显遗憾的是,在设计上应用分子残留病灶(MRD)的免疫辅助治疗研究(MERMAID系列研究)据称已提前 被砍 。
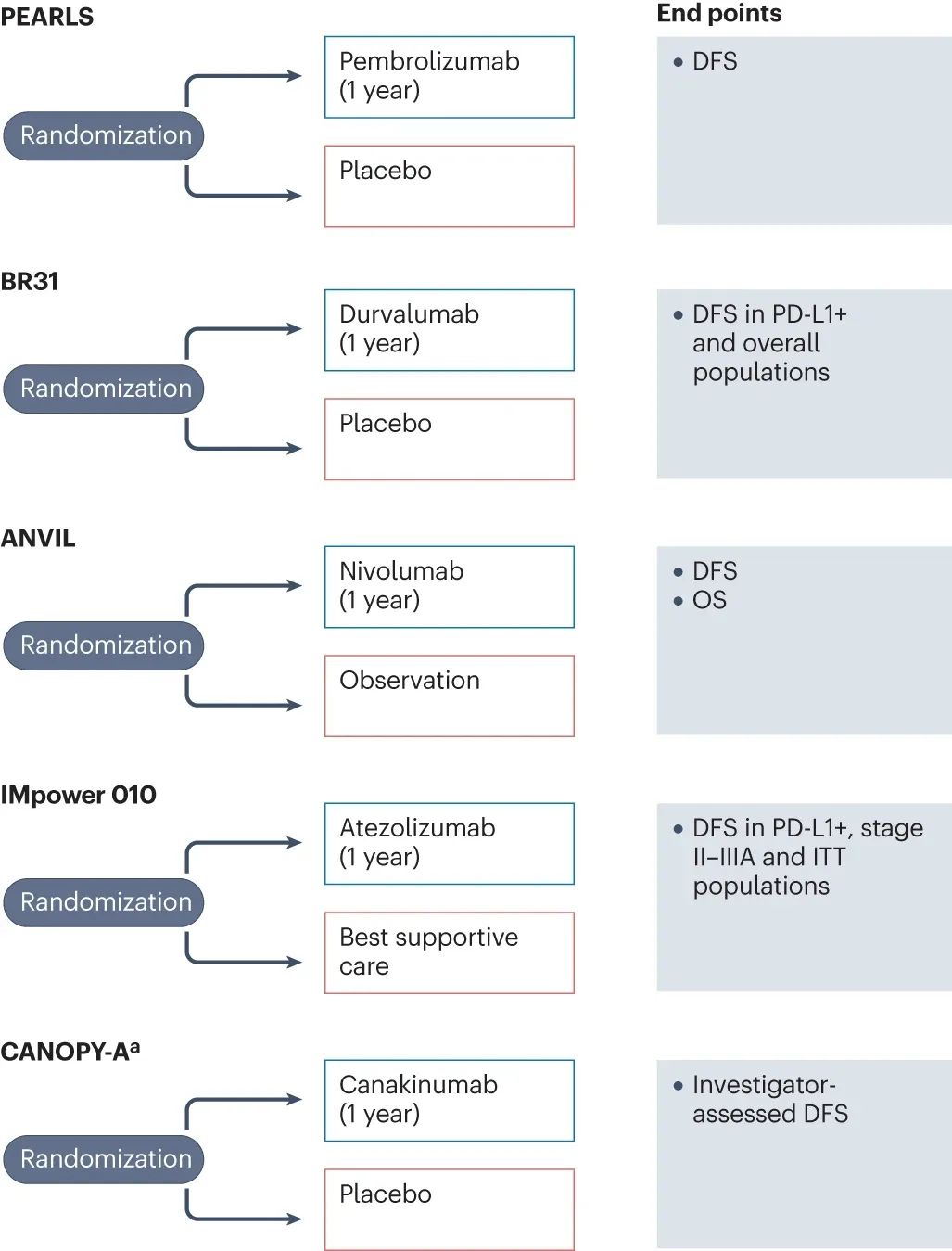
正在进行中的免疫辅助治疗关键临床研究
夹心饼 式免疫治疗现状
主要探索免疫新辅助治疗可行性的NADIM、LCMC3等标志性临床早期研究,其实都同时给 夹心饼 式免疫治疗的可行性提供了证据,特别是患者长期生存率相当出色,如NADIM研究中IIIA期患者的3年OS率高达81.9%[5],后续开展的随机对照研究NADIM II,也于近期正式发表了出色的生存获益数据。
而在2023年,AEGEAN、NEOTORCH、KEYNOTE-671三项设计相似的随机对照临床III期研究,相继公布MPR/pCR和EFS阳性结果,标志着 夹心饼 式免疫治疗全面成功,奇点糕此处就不列举疗效数据了。不过截至本文发稿时, 夹心饼 式免疫治疗尚未正式获批应用,可能与上述研究OS数据均未成熟有关。
其它正在进行的 夹心饼 式免疫治疗关键临床III期研究中,新辅助阶段采用免疫+立体定向放疗(SBRT)方案的KEYNOTE-867研究也值得关注,此前在临床II期研究中,免疫+SBRT方案治疗的MPR/pCR率为53.3%/26.7%[6]。
说了这么多大家耳熟能详的成果,NSCLC围术期的免疫治疗,前景似乎是一片光明,可是哪有100%顺利的事情呢?接下来就该进入机遇与挑战的篇章啦。
NSCLC围术期免疫治疗的机遇与挑战
外科手术考量
不论是哪种围术期免疫治疗模式,都不能 喧宾夺主 、取代外科手术切除,这也是免疫新辅助和辅助治疗的差异所在:前者虽然可以缩瘤降期、更好地激活免疫应答,但也确实存在治疗期间因病情进展或显著副作用,导致患者失去手术机会的风险,而免疫辅助治疗则不会对外科手术进程产生影响。
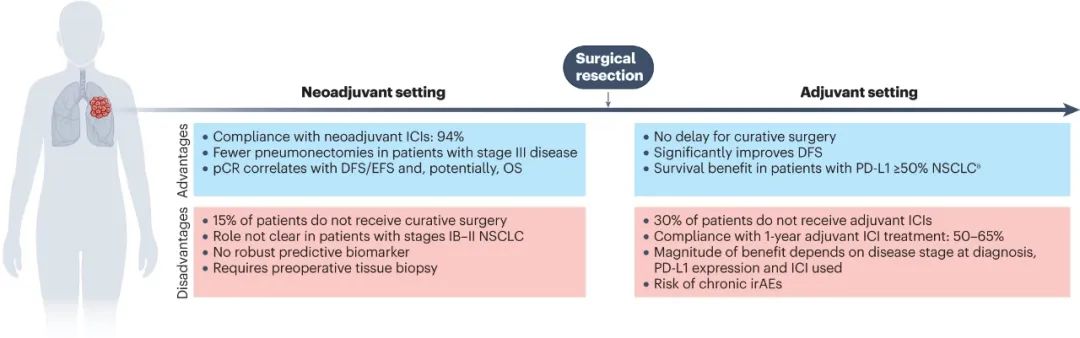
从外科视角看免疫新辅助和辅助治疗的差异
在关键临床III期研究中,接受免疫新辅助治疗或 夹心饼 式免疫治疗的患者,至多有20%无法按计划完成外科手术切除,甚至有II期研究报告称,接受免疫新辅助治疗患者的术后90天内死亡率高达9%[7],这可能与免疫治疗激活的免疫和炎症反应过强有关,外科医生必须全盘考虑、权衡每一例患者的利弊。
此外,现有的免疫新辅助治疗研究均未考虑 转化治疗 ,即将初始判定不可切除的NSCLC转化为可切除的用法,研究入组患者均为初治可切除患者(大多为IB-IIIA期,少数含IIIB期患者),对减少手术中肺切除范围的影响也不明显,这些问题有待后续研究给出答案。
临床实践适用性问题
就治疗依从性而言,免疫新辅助治疗一般只需2-4个21天周期,因此大多数患者能够接受,但为期1年的免疫辅助治疗就不同了,IMpower010和KEYNOTE-091研究的辅助治疗完成比例分别只有65%和52%,未来临床医生可能需要基于新辅助治疗或生物标志物情况,筛选最有可能获益或最需要免疫辅助治疗的患者。
另一大问题则是免疫新辅助/辅助治疗,与当前临床常规流程的 兼容性 ,例如免疫辅助治疗前患者是否必须经受辅助化疗、具体应采用何种含铂化疗方案;免疫新辅助治疗前是否需检测EGFR/ALK等驱动基因突变等,现有临床研究的相关亚组分析普遍样本量偏小且非预设,回答这些问题仍比较困难。
液体活检和生物标志物的应用
多项免疫新辅助治疗临床研究都开展过ctDNA检测相关分析,普遍显示新辅助治疗后患者ctDNA水平下降乃至完全清除,与更高的MPR/pCR率及患者更好的长期预后有关,特别是CheckMate-816研究中,ctDNA完全清除患者有46%达pCR,因此将基于ctDNA的液体活检与影像学等手段联合使用,有较好的临床价值。
免疫辅助治疗中目前流行的评估标准,则是近年来备受关注的分子残留病灶(MRD),检测指标也主要是ctDNA,但IMpower010研究的探索性分析显示,患者术后MRD是否阳性,对阿替利珠单抗的治疗获益影响不大,MRD仅应作为预后评价指标而非免疫疗效预测指标[8],未来可能需要更动态的评估手段。
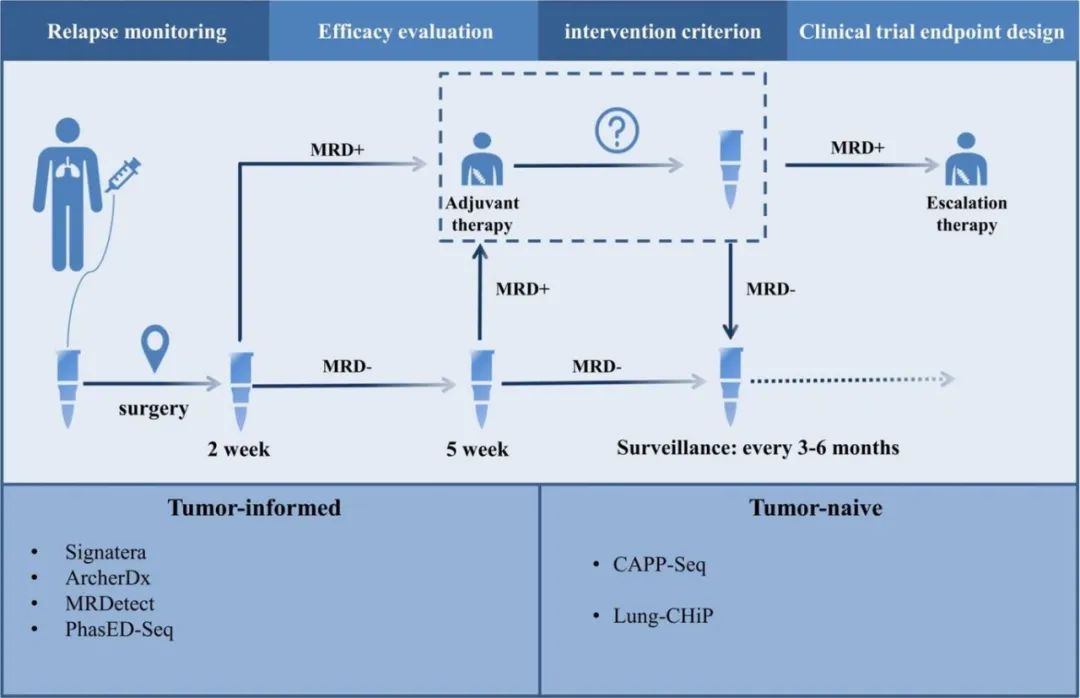
MRD对免疫辅助治疗的指导意义
(图片来源:Critical Reviews in Oncology/Hematology)
驱动基因阳性患者的治疗
针对EGFR、ALK等常见驱动基因突变,以及罕见驱动基因变异的TKI类靶向药已非常成熟,靶向辅助治疗已有标志性的ADAURA研究结果公布,新辅助治疗临床研究也接近收获期,但对存在TP53、STK11等常见共突变,且尚无靶向药可用的患者,是否应行围术期免疫治疗仍是 知识盲区 ,亟需相关分析。
辅助治疗用药时长问题
IMpower010和KEYNOTE-091研究均将免疫辅助治疗时长定为1年(即17个周期),但并无法验证1年时长是否为最优解。从免疫治疗用于晚期NSCLC的经验来看,达到缓解的患者持续用药可长期获益,而在免疫辅助治疗阶段,可能需要以新辅助治疗的病理应答情况即是否达到MPR/pCR,或患者基线特征来判断用药时长。
临床研究终点选择问题
OS无疑是抗癌治疗临床研究的金标准,但在可手术NSCLC的临床研究中,得到OS结果往往需要较长时间的随访,且结果还会受到许多因素的干扰,如晚期NSCLC靶向和免疫治疗临床研究中,后线治疗就有极大的影响。
围术期免疫治疗关键临床研究中,OS基本都作为次要终点,MPR/pCR和DFS、EFS等 替代终点 普遍是研究主要终点,但仍无权威证据提示 替代终点 对OS的预示意义。此外,免疫治疗还可能通过预防继发/第二次恶性肿瘤发生,改善临床研究OS数据,具体影响幅度则需要更多数据和更长久的随访。
疾病复发后的免疫治疗 再挑战
晚期NSCLC免疫治疗临床研究数据显示,对疾病复发/进展患者尝试免疫再挑战有一定获益[9],在可手术NSCLC患者中的可行性则尚无证据,如现有临床研究的随访较为完善,应尽快评估免疫再挑战对患者预后的影响,以及最优的治疗模式、用药时长等,这也是临床医生和患者高度关注的问题。
结语
从上面的一系列问题可以看出,可手术NSCLC围术期免疫治疗的 大厦 还远未建成,天空飘着各种各样颜色的云,解决这些问题不仅需要更多的临床研究和数据,还需要先进的检测手段、常态化多学科会诊和药物可及性等方面的改进,众人拾柴火焰高、多方面努力肺癌治愈希望才高嘛。
参考文献:
[1]Mountzios G, Remon J, Hendriks L E L, et al. Immune-checkpoint inhibition for resectable non-small-cell lung cancer opportunities and challenges[J]. Nature Reviews Clinical Oncology, 2023.
[2]Matzner P, Sandbank E, Neeman E, et al. Harnessing cancer immunotherapy during the unexploited immediate perioperative period[J]. Nature Reviews Clinical Oncology, 2020, 17(5): 313-326.
[3]Liu J, Blake S J, Yong M C R, et al. Improved efficacy of neoadjuvant compared to adjuvant immunotherapy to eradicate metastatic disease[J]. Cancer Discovery, 2016, 6(12): 1382-1399.
[4]Aokage K, Shimada Y, Yoh K, et al. Pembrolizumab and ramucirumab neoadjuvant therapy for PD-L1-positive stage IB-IIIA lung cancer (EAST ENERGY)[J]. Journal of Clinical Oncology, 2023, 41(Supplement_16): 8509.
[5]Provencio M, Serna-Blasco R, Nadal E, et al. Overall survival and biomarker analysis of neoadjuvant nivolumab plus chemotherapy in operable stage IIIA non small-cell lung cancer (NADIM phase II trial)[J]. Journal of Clinical Oncology, 2022, 40(25): 2924-2933.
[6]Altorki N K, McGraw T E, Borczuk A C, et al. Neoadjuvant durvalumab with or without stereotactic body radiotherapy in patients with early-stage non-small-cell lung cancer: a single-centre, randomised phase 2 trial[J]. The Lancet Oncology, 2021, 22(6): 824-835.
[7]Wislez M, Mazieres J, Lavole A, et al. Neoadjuvant durvalumab for resectable non-small-cell lung cancer (NSCLC): results from a multicenter study (IFCT-1601 IONESCO)[J]. Journal for Immunotherapy of Cancer, 2022, 10(10): e005636.
[8]Zhou C, Thakur M D, Srivastava M K, et al. 2O IMpower010: Biomarkers of disease-free survival (DFS) in a phase III study of atezolizumab (atezo) vs best supportive care (BSC) after adjuvant chemotherapy in stage IB-IIIA NSCLC[J]. Annals of Oncology, 2021, 32(Supplement 7): S1374.
[9]Rodriguez-Abreu D, Wu Y L, Boyer M, et al. OA15. 06 Pooled Analysis of Outcomes with Second-Course Pembrolizumab Across 5 Phase 3 Studies of Non-Small-Cell Lung Cancer[J]. Journal of Thoracic Oncology, 2022, 17(9 Supplement): S42-S43.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















