Science:人类为何易患阿尔茨海默病?这种长链非编码RNA或是罪魁祸首 |
 |
来源:生物世界 2023-09-18 15:45
总而言之,这项发表于 Science 的最新研究表明,Aβ病理可以诱导人类神经元发生坏死性凋亡,而MEG3的急剧上调是其关键因素。比利时VIB-KU鲁汶脑与疾病研究中心的Bart De Strooper团队在国际顶尖学术期刊Science上发表了题为:MEG3 activates necroptosis in human neuron xenografts modeling Alzheimer s disease的研究论文。
该研究表明,在移植了人类或小鼠神经元的小鼠模型的大脑中,只有人类神经元表现出严重的阿尔茨海默病病理,包括神经原纤维缠结和神经元坏死性凋亡。而长链非编码RNA-MEG3在阿尔茨海默病病变的人类神经元中被强烈上调,通过药理或遗传学手段下调MEG3,可挽救异种移植人类神经元中的神经元丢失。
这一发现揭示了人类神经元对阿尔茨海默病的独特易感性,并提示了阿尔茨海默病的潜在治疗靶点。

-淀粉样蛋白(A )斑块、神经原纤维缠结、颗粒空泡性神经变性(GVD)和神经元丢失是阿尔茨海默病的常见病理特征。阿尔茨海默病小鼠模型是研究阿尔茨海默病的经典动物模型,但这些动物模型通常是由人工诱导的,难以解释这些病理特征是如何相互关联的。
事实上,一直以来,关于A 病理是否可以诱导tau缠结以及神经元如何在阿尔茨海默病中死亡的基本问题仍然没有得到解答。有两种很好的模型可以复制阿尔茨海默病的人类病理特征 3D人脑类器官,以及在小鼠大脑中异种移植人类神经元。
在这项最新研究中,研究团队改进了先前基于Nod-SCID小鼠的异种移植模型,使用Rag2 / (Rag2tm1.1Cgn)抑制遗传背景和单个AppNL-G-F(Apptm3.1Tcs/Apptm3.1Tcs)敲入基因来驱动A 病理。研究团队将人类来源的神经祖细胞(NPCs)移植到这些含有A 的小鼠大脑中,两者整合良好并发育出神经元树突棘。移植两个月后,异种移植的神经元已经显示出一些成熟神经元标志物(NEUN、MAP2)和皮层标志物(CTIP2、SATB2、TBR1、CUX2)的特征。
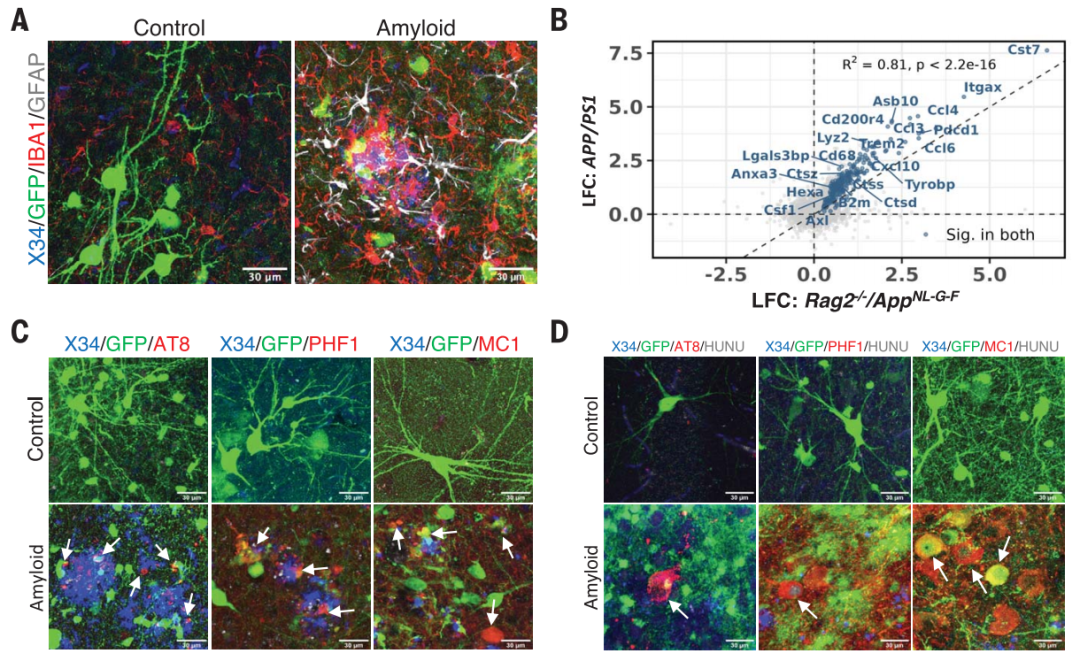
淀粉样斑块的沉积足以在异种移植动物模型中诱导缠结
与移植小鼠神经元的对照组相比,移植人类神经元的小鼠表现出严重的阿尔茨海默病病理,包括神经原纤维缠结、颗粒空泡性神经变性(GVD)、磷酸化tau蛋白血液生物标志物和相当大的神经元损失。这表明存在未知的人类特异性特征定义了人类神经元对A 病理的敏感性。
异种移植人类神经元表现出严重的阿尔茨海默病病理
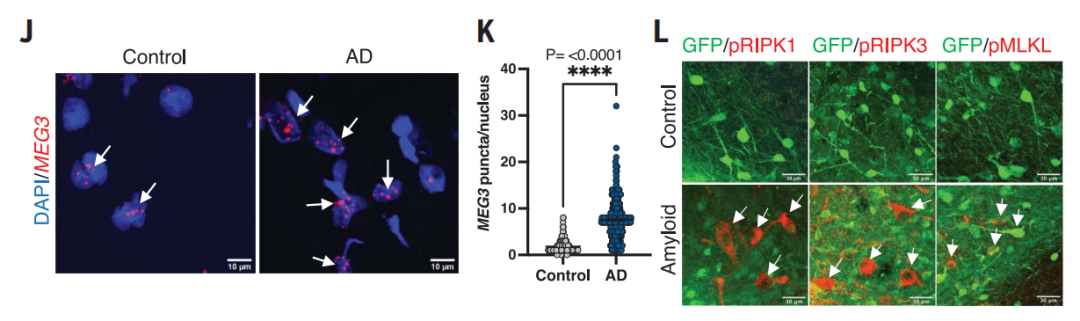
转录组学分析显示,一种长链非编码RNA(lncRNA) 神经元特异性母源表达基因3(MEG3)在病变的人类神经元中被强烈上调了大约10倍。值得一提的是,这种神经元特异性长链非编码RNA在阿尔茨海默病患者中也有2-3倍的上调。
异种移植人类神经元的转录组变化
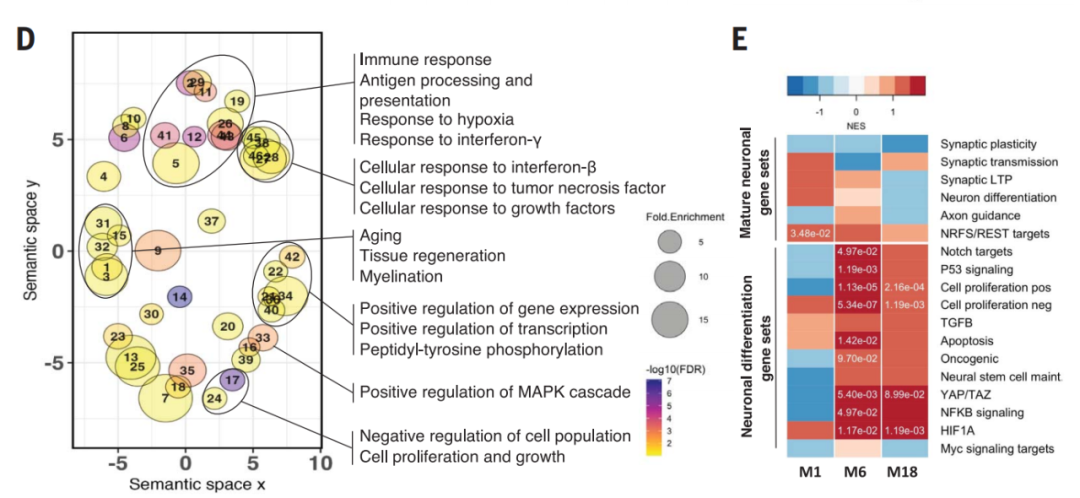
进一步研究表明,MEG3在体外过表达足以诱导人类神经元坏死性凋亡,而通过药理或基因操控受体相互作用蛋白激酶(RIPK1、RIPK3)或混合谱系激酶结构域样蛋白(MLKL)来下调MEG3,可以抑制人类神经元的坏死性凋亡,挽救异种移植动物模型中的神经元细胞损失。
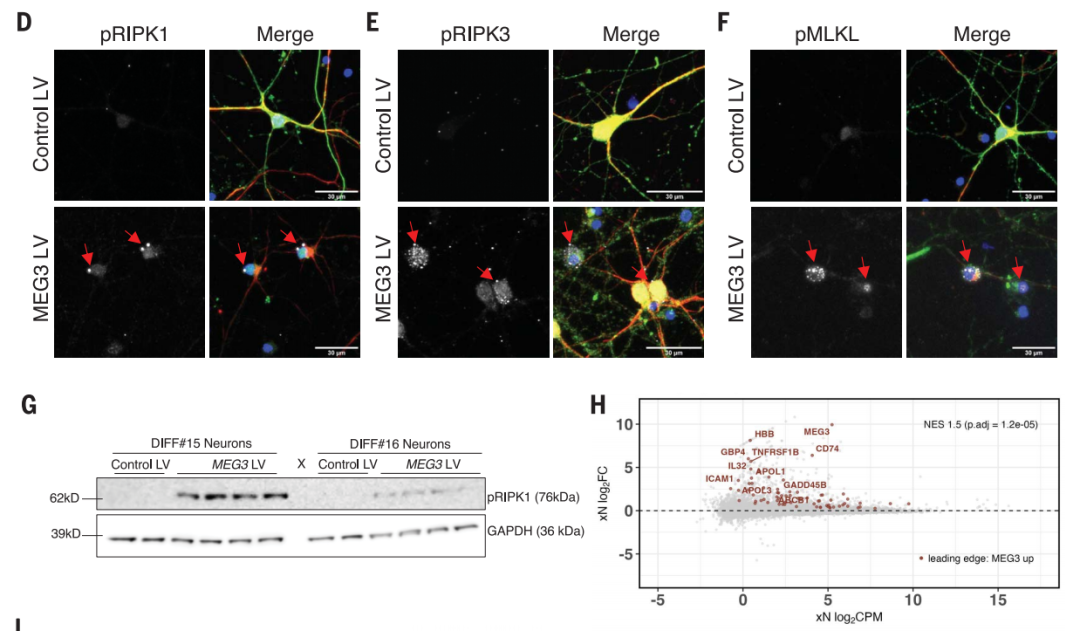
lncRNA-MEG3诱导人类神经元的坏死性凋亡
总而言之,这项发表于Science的最新研究表明,A 病理可以诱导人类神经元发生坏死性凋亡,而MEG3的急剧上调是其关键因素。因此,阿尔茨海默病的神经元丢失可以通过下调MEG3的表达或抑制坏死性凋亡途径来挽救,这也为阿尔茨海默病的防治带来了全新的潜在靶点和方法。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- Cell Genomics:AI 助力抗癌新突破!机器学习模型精准预测肿瘤侵袭性 (2025-07-30)
- Cell:我国科学家利用人工智能驱动的策略实现了蛋白质的快速高效进化 (2025-07-29)
- 第四届国际生物医药产业发展大会 (2025-07-29)
- 2025年7月Cell期刊精华 (2025-07-29)
- Cell:告别“单兵作战”!SPIDR技术开启“联合作战”新纪元,一次实验看清数十种RNA调控蛋白的“社交网络” (2025-07-29)
- Nature:中国学者开发基因编辑蚊子,有望终结疟疾传播 (2025-07-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















