Nature:王开拓等解析丙肝病毒HCV表面糖蛋白E1/E2高阶复合物结构 |
 |

技术上,由病毒学家和结构生物学家组成的联合研究团队在多年的合作研究中进行了多项技术创新,最终取得了这一成果。E1和E2蛋白的N末端和C末端对蛋白结构和功能至关重要,因此无法使用传统标签方法进行纯化。在先前的Science文章研究中,研究者采用带有Strep标签的单克隆抗体与蛋白复合物共表达,以抗原-抗体复合物的形式纯化整个蛋白复合物。而在本研究中,研究者将Strep标签设计在E2蛋白中间的一个柔性loop区,并进行了功能验证,使得单独纯化蛋白复合物成为可能。此外,由于蛋白复合物表达量极低且在体外体系中极不稳定,研究者克服了蛋白纯化和冷冻制样过程中的多项技术难题。在每次大规模纯化中仅能得到小于10微克样品的情况下,研究者成功对蛋白进行了结构解析。
针对蛋白样品的柔性,研究者们采用了多种新的冷冻电镜结构解析技术、密度加强及模型搭建算法。特别是在Alphafold【3】结构预测和基于深度学习的三维密度图后处理算法EMReady【4】的帮助下,研究者构建了几乎所有氨基酸序列的结构模型,覆盖了E1序列的96%和E2序列的90%。相比之下,Science文章中的结构模型仅包括51%的E1和82%的E2序列。
文章中最重要的发现是E1/E2异聚体能进一步组装成更高阶的二聚体复合物。这种二聚化是由E2蛋白介导的,相互作用面积约为1200平方埃,主要基于位于蛋白表面的多个氨基酸间的疏水或氢键相互作用,而蛋白表面的糖基基本不参与二聚化。二聚化使得此区域被包裹在复合体内部,而其他暴露区域表面多数都是高度糖基化的,这可能解释了HCV E1/E2糖蛋白复合物的低免疫原性。作者在此基础上开展了一系列的蛋白突变体生化和免疫实验,证明了二聚体界面中的氨基酸序列非常保守,对其突变会影响二聚体的稳定性。此外,先前的研究结果也显示,位于二聚化界面上至少一半的氨基酸残基在所有亚型HCV中都完全保守,且其突变会影响HCV假病毒颗粒(HCV pseudoparticle,或者HCVpp)对细胞的侵染活性【5】。
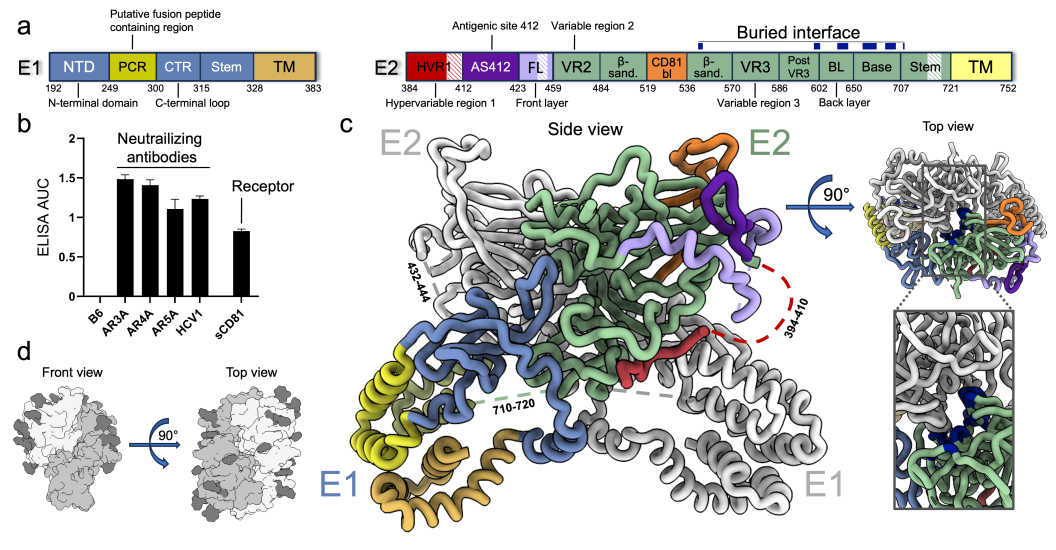
图二:HCV E1/E2蛋白复合物的冷冻电镜结构(Credit:Nature)
此次解析的结构还揭示了多种此前研究中未被观察到的结构细节。首先,复合物的跨膜螺旋区结构首次得到解析,复合物结构中的跨膜蛋白束排列较松散,平均分辨率约5埃,但结合Alphafold结构预测,研究者仍能搭建来自两个蛋白的总共6个跨膜螺旋模型。其中,M1-M2来自E1蛋白的PCR (putative fusion peptide containing region)区域,M1和M2螺旋中间的链接区域(272-281位氨基酸)非常保守,被认为是介导病毒颗粒与侵染细胞融合的肽段(putative fusion peptide,简称pFP);M3-M4来自E1蛋白的C端,M3前面还发现了一个可能平行于膜所在平面的螺旋,命名为MX螺旋;M5-M6位于E2蛋白的C端。
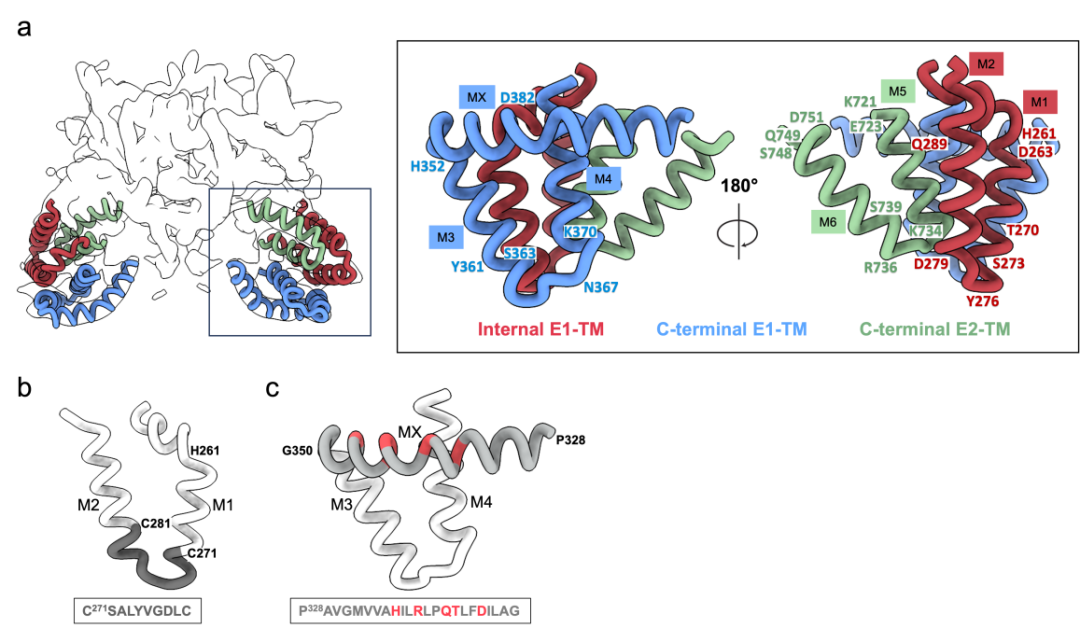
图三:HCV E1/E2复合物中跨膜结构域的位置和结构(Credit:Nature)
其次,结构中首次解析了E2蛋白N末端的区域,包括序列最多样化的hypervariable region 1 (HVR1)以及序列保守但结构非常不稳定的antigenic site 412 (AS412)。这些区域被认为对HCV的免疫逃逸至关重要,但其具体作用机制和结构尚不完全清楚。结构分析发现,HVR1区域可以隐藏多种HCV中和抗体的识别表位以及受体CD81的结合表位,而体外实验也证明,样品与多种中和抗体和受体CD81的结合能力在4摄氏度时较低,在温度升高时会升高,这暗示了此部分结构在病毒侵染和被免疫系统识别时需要进行一定程度的重排。
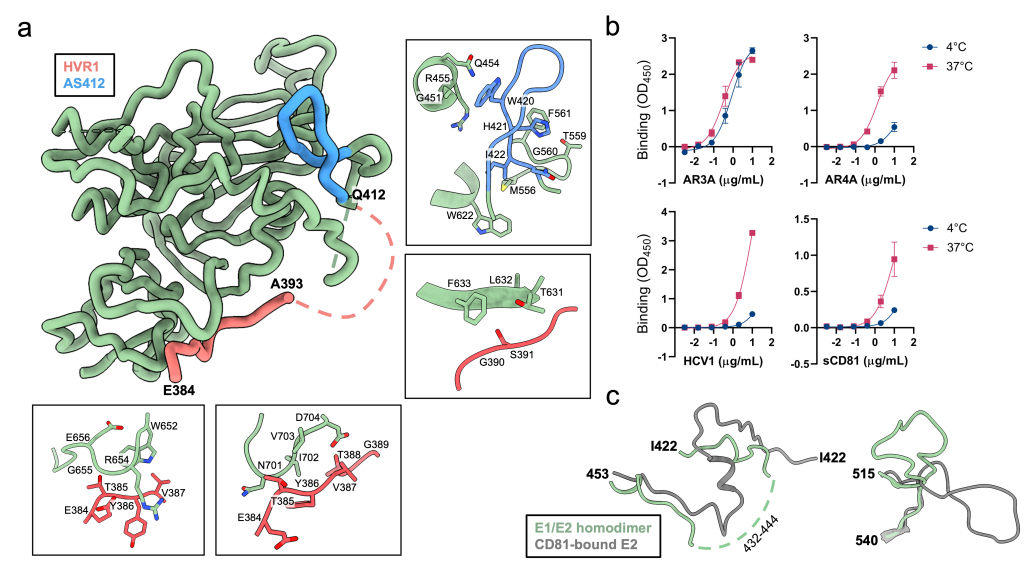
图四:E2蛋白N末端HCV1和AS412区域的结构及其对蛋白结合能力的影响(Credit: Nature)
医药网新闻
- 相关报道
-
- 第八届(2025)中国医疗器械创新创业大赛人工智能与医用机器人类别赛圆满落幕 (2025-10-21)
- 《肝病学》:世界首例活体异种肝移植!基因改造猪肝体内存续38天,患者存活171天 (2025-10-21)
- 《癌症研究》:手术促癌转移证据+1!科学家发现,手术会导致中性粒细胞胞外陷阱形成,重编程癌细胞代谢,促进癌细胞存活和转移 (2025-10-21)
- Nature Genetics:变“在场”为“在岗”——基于剪接修复的活性筛选系统,重塑高分辨率碱基编辑扫描新范式 (2025-10-21)
- 儿童营养不良后增重别盲目!Matern Child Nutr:男性康复期快速增重,成年肥胖风险显著升高 (2025-10-20)
- 《自然》杂志刊文:首次揭示决定胰腺癌细胞命运的关键调控因子 (2025-10-20)
- 芯明与华西医院达成战略合作,共同构建智能化医疗运营体系 (2025-10-20)
- Nature Biotechnology:植物免疫的“换芯”手术——跨越物种界限,打造广谱抗病的超级作物 (2025-10-20)
- 皮肤老得快、伤口难愈?Nature 揭秘:毛细血管“守护神”CAMs 丢了是关键,补回来能焕活血管 (2025-10-20)
- Cancer Cell:肿瘤内细菌,驱动癌症治疗耐药性 (2025-10-19)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















