Cell:皮肤伤口修复的必经之路:组织流动性的动态调控 |
 |

IFE内SCs更新能力增强以促进表皮伤口修复
既往的皮肤损伤模型通常造成皮肤的大面积损伤,引起出血和严重的炎症反应,使得再生能力下降,并给干细胞动态研究增加很多变量,无法进行准确追踪。该研究使用K14rtTA/TetO-DTA x K14CREER/Rosa-confetti工程鼠,通过表皮涂抹doxyclycline(DOX)诱导基底细胞死亡,Tamoxifen(TAM)处理对基底细胞进行追踪。研究发现,该模型能够特定诱导基底细胞层的组织损伤,而不影响表皮整体结构和上层分化细胞稳态;损伤后1-4天内看到大量细胞增殖并在第4天达到峰值,之后逐渐降低直至11天重新回到稳态。通过克隆追踪和组织染色等方法对1-11天样本进行分析发现,组织再生过程伴随克隆数(clone size)的逐渐增多,相较于11天的对照组样本,平均基底克隆大小增大14倍,由此说明基底细胞死亡诱导干细胞由不对称分裂(asymmetrical division)到对称分裂(symmetrical division)的瞬时变化,从而实现克隆扩增。
表皮伤口修复中的动态变化描述: 组织流动性
通过动物实验研究人员发现,在皮肤再生过程中,细胞浓度和面积有很大的改变,猜测SCs的激活可能和局部细胞浓度、细胞间物理接触有一定相关性。由此,研究人员采用计算细胞空间变化和预测组织机制的Voronoi model【2】进行分析。研究首先假设这种动态变化是基于浓度改变的一种反馈机制: 即局部细胞浓度降低时,干细胞进入对称分裂复制过程直到达到原有稳态浓度,反之则进入不对称分裂,降低增值速度,产生分化细胞。通过计算模拟发现确实如此,细胞死亡后初期,细胞重编排能力增强,细胞分裂能力提高,提示基底层内存在组织流动性(fluidity)的动态变化。
接下来,研究人员将上述模型预测的结果在动物模型内进行进一步验证。组织流动性(tissue fluidity)【3】通常使用细胞重排率进行描述(degree of cellular rearrangements),这里用T1 transitions的频率(frequency of T1 transitions)为参数进行细胞重排率计算,T1 transition速率(rate)越高,组织内机械压力也就越大,组织结构就更偏向类液态环境(Figure 1A B)。通过对皮肤修复过程中不同时间点的组织进行分析后发现,修复早期T1 transitions升高,在第2天达到高峰,之后逐渐下降,11天恢复和control动物一致 (Figure 1D)。该研究证实在皮肤修复过程中存在组织流动性的动态变化,这种变化和SCs分裂相关。
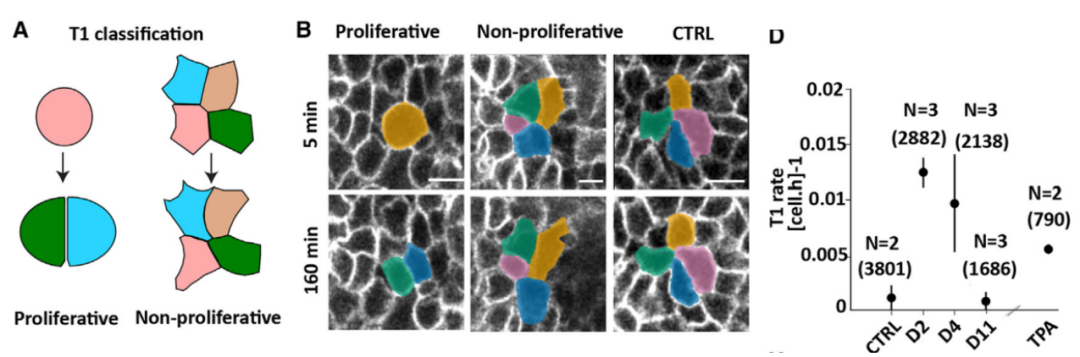
Figure 1. T1 transition rate.(Credit:Cell)
表皮伤口修复过程的分子机制研究
接下来,研究人员对不同时间点的组织进行转录水平测序、单细胞水平和表观遗传分析发现,epiregulin表达、EGFR激活和Jun表达在细胞损伤后第2天开始上调,在第4天达到峰值,之后逐渐下调,这和之前观测到的动态变化保持一致。同时,研究人员在表皮损伤后使用ErbB家族抑制剂afatinib、MEK家族抑制剂trametinib和Jun家族AP1抑制剂T-5224对动物模型进行处理,结果显示这些抑制剂都能够抑制干细胞激活和扩增,加速损伤进程,由此证明EGFR/MARK/AP1信号轴在干细胞促进修复过程中的重要作用。
总的来说,本研究通过开发新型动物模型和分析方法,阐述了皮肤伤口修复过程中,组织流动性的改变激活干细胞EGFR/AP1信号通路,从而增强干细胞增殖能力,补充细胞损失,提高伤口局部细胞浓度,从而完成修复。该研究为研究皮肤干细胞功能和再生机制提供了新的思路。
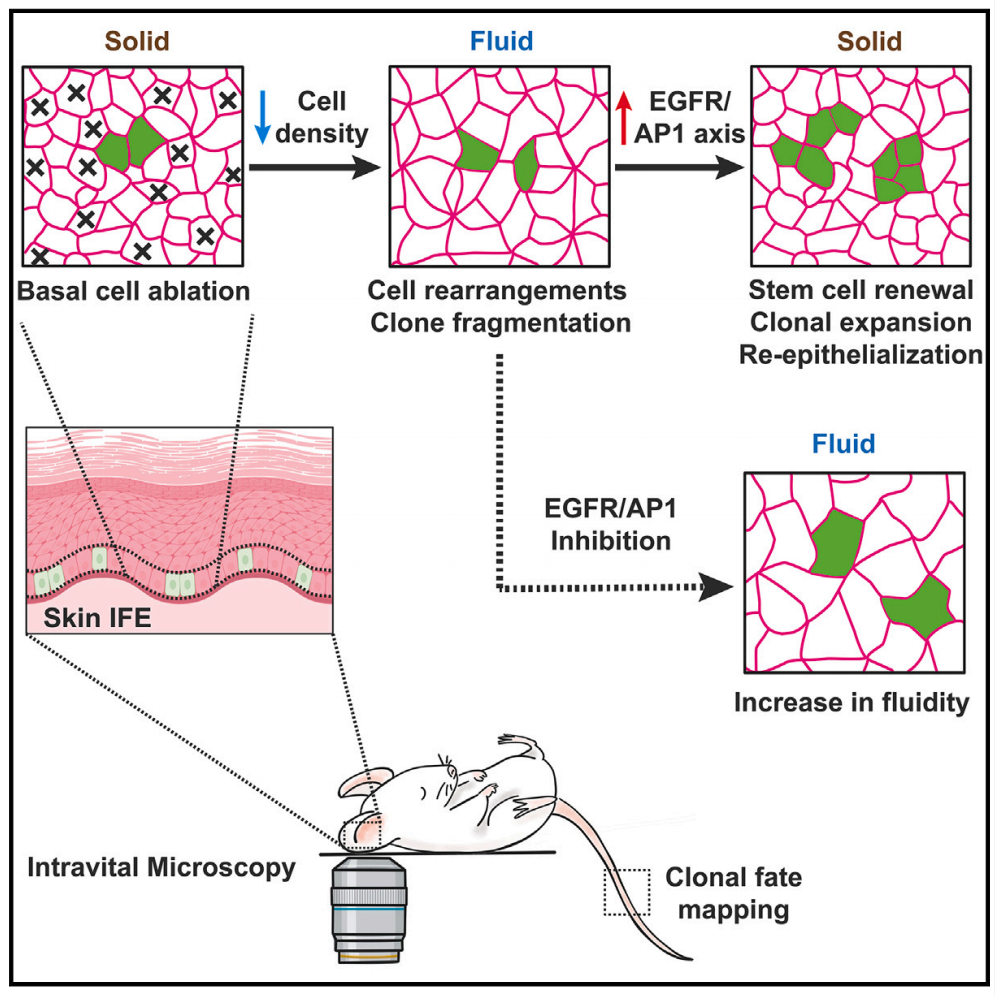
模式图(Credit: Cell)
医药网新闻
- 相关报道
-
- 迈迪斯亮相HICOOL2025全球创业者峰会 微创导航技术破解临床穿刺难题 (2025-10-24)
- 清华大学最新Cell论文:娄智勇/饶子和团队发现冠状病毒复制模板循环与RNA加帽的协同机制 (2025-10-24)
- 攻克LAM肺修复难题!Nature Communications重磅:mTOR-IL-6轴驱动肺泡细胞衰老,双靶联合治疗或成破局关键 (2025-10-24)
- 抗肿瘤药物甲氨蝶呤血药浓度快速监测研究获进展 (2025-10-24)
- 每 36 个娃就有 1 例,但病因成谜?! Transl Psychiatry:科学家破译自闭症患者的细胞“求救信” (2025-10-24)
- Nat Metabol:癌细胞也爱“吃醋”?科学家发现巨噬细胞竟是肝癌转移的“燃料供应商”! (2025-10-24)
- 全球首个百亿级人类基因组基础模型Genos发布! (2025-10-23)
- CRISPR编辑肝类器官破解凝血因子VII缺乏症难题!Haematologica开辟罕见出血病自体治疗新范式 (2025-10-23)
- 《细胞》:肿瘤被“坑”杀!哈佛大学团队发现全新抗癌结构,杀伤性T细胞可在里面直接杀死癌细胞 (2025-10-23)
- Nature子刊:鲁明/钦伦秀团队发现肿瘤相关巨噬细胞促进肝癌转移的新机制 (2025-10-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















