Science:T细胞为何会“疲惫不堪”?代谢与表观遗传的答案 |
 |
免疫系统的 瓶颈 :为何T细胞会耗竭?
在面对癌症和慢性感染时,免疫系统的持续压力常常导致T细胞功能的逐渐衰退,即 耗竭 (T cell exhaustion, TEX)。这种现象并非简单的疲惫,而是一种复杂的适应性反应,其根本原因在于抗原的长期刺激迫使T细胞持续作战,最终无法维持正常的效应功能。耗竭性T细胞不仅在抗病毒和抗肿瘤免疫中失去高效的杀伤能力,还成为当前许多免疫治疗手段成效不佳的主要障碍。
研究发现,耗竭性T细胞在分子层面呈现出显著的转录和表观遗传重塑。这些细胞通常伴随着高水平的抑制性受体表达,如PD-1和TIM-3,限制了其响应抗原刺激的能力。此外,T细胞的分化也出现分支,一部分细胞成为具备一定增殖潜力的 始祖型 耗竭性T细胞(TEXprog),另一部分则演化为功能完全衰竭的 终末型 耗竭性T细胞(TEXterm)。值得注意的是,TEXprog细胞虽具有一定的恢复潜力,但数量有限,无法有效扭转免疫疲软的局面。
耗竭的另一个关键特征是代谢的重塑。相比于功能正常的效应T细胞(TEFF),耗竭性T细胞表现出代谢活性的下降,例如线粒体功能减弱以及更依赖于糖酵解路径。这种代谢转变直接影响了细胞内乙酰辅酶A的生成,进一步削弱了表观遗传层面的调控能力。数据显示,在慢性抗原刺激下,CD8+ T细胞中负责乙酸代谢的ACSS2显著下降,而负责葡萄糖代谢的ACLY则维持甚至略微增强,这种酶水平的变化是耗竭性T细胞命运的重要驱动因素。
这一代谢与表观遗传的交互作用,为理解T细胞耗竭提供了新的视角。
转录与代谢的双重调控:解锁T细胞功能的密码
在免疫系统的复杂网络中,CD8+ T细胞的功能表现不仅依赖于基因表达的调控,还深受细胞代谢状态的影响。这两者在T细胞耗竭中紧密交织,共同塑造了细胞的命运与功能。
耗竭性T细胞(TEX)之所以在面对癌症和慢性感染时显得无能为力,其根源在于其表观遗传和代谢的全面重塑。研究发现,TEX细胞的基因表达谱与功能效应性T细胞(TEFF)显著不同,许多与免疫效应相关的关键基因被关闭,而抑制性受体相关基因则被激活。这种转录状态的改变由表观遗传修饰驱动,其中组蛋白乙酰化是重要的调控开关。组蛋白乙酰化不仅决定了染色质的开放程度,也影响了基因是否能够被有效转录。
然而,组蛋白乙酰化所需的乙酰辅酶A(acetyl-CoA)生成依赖于细胞代谢。功能正常的TEFF细胞倾向于通过乙酸和葡萄糖代谢产生足量的乙酰辅酶A,以维持其高效的基因表达水平。而在TEX细胞中,代谢路径发生了显著改变,乙酸代谢相关酶ACSS2的表达大幅下降,导致依赖乙酸生成的乙酰辅酶A不足。这种代谢障碍进一步削弱了表观遗传修饰的能力,使得TEX细胞更加趋向于抑制性基因表达。
此外,负责葡萄糖代谢的ACLY在TEX细胞中依然活跃,部分弥补了乙酰辅酶A的缺失,但其功能主要集中在支持耗竭终末型T细胞(TEXterm)的分化,而非维持始祖型耗竭性T细胞(TEXprog)的活力。这一代谢重编程与表观遗传调控之间的动态关系,使得TEX细胞在功能上逐渐丧失效应潜能。
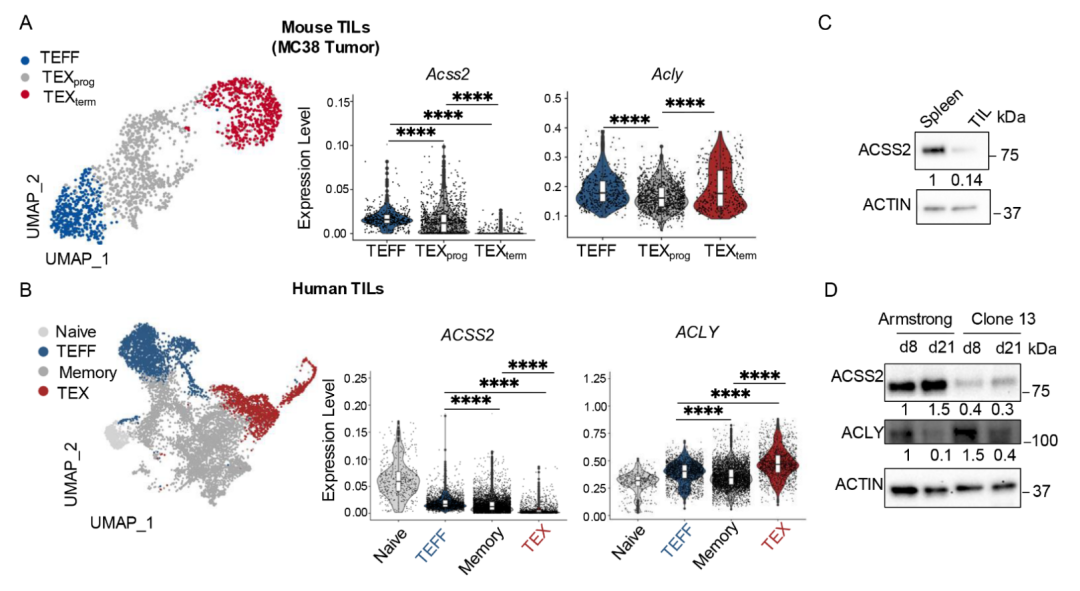
ACSS2和ACLY在耗竭性T细胞(TEX)中的表达差异(Credit:Science)
ACSS2和ACLY基因表达的单细胞RNA测序分析(scRNA-seq)
图A显示,在小鼠CD8+肿瘤浸润淋巴细胞(TILs)中,通过综合分析1849个CD8+ T细胞的scRNA-seq数据(来源于GSE171194和GSE235195),发现Acss2的mRNA表达在功能性T细胞中较高,而在耗竭性T细胞中显著降低;与之相比,Acly的mRNA表达在耗竭性T细胞中维持稳定,甚至略有增加。
图B进一步验证了这一现象在人类数据中的一致性。综合分析了三个公开数据集(GSE146771, GSE99254, GSE98638)中共9043个CD8+ TILs的表达数据,同样观察到Acss2在耗竭性T细胞中表达降低,而Acly表达持续稳定。
蛋白水平的ACSS2和ACLY表达检测
图C通过Western blot分析比较了小鼠脾脏中的CD8+ T细胞与MC38肿瘤中的肿瘤浸润淋巴细胞(TILs),结果显示,ACSS2在肿瘤环境中的CD8+ TILs中表达显著低于脾脏中的功能性T细胞。
图D进一步在慢性病毒感染模型(LCMV-Armstrong和LCMV-clone 13)中探讨了ACSS2和ACLY的动态表达。结果显示,与急性感染模型(Armstrong)相比,慢性感染模型(clone 13)中P14+ CD8+ T细胞的ACSS2蛋白表达明显减少,而ACLY的表达在耗竭性T细胞中保持不变甚至有所增加。
乙酰辅酶A的秘密:营养代谢如何重塑T细胞命运?
在CD8+ T细胞的生命周期中,乙酰辅酶A(acetyl-CoA)不仅是代谢活动的核心分子,更是表观遗传调控的关键。它驱动组蛋白乙酰化这一重要修饰,从而决定染色质的开放性及特定基因的表达。研究发现,乙酰辅酶A的来源和利用方式直接影响了T细胞从效应型(TEFF)向耗竭型(TEX)分化的命运。
两种代谢酶在乙酰辅酶A的生成中扮演了截然不同的角色:ACSS2和ACLY。ACSS2专门利用乙酸(acetate)生成乙酰辅酶A,主要在功能性TEFF和TEX的始祖型细胞(TEXprog)中高度表达。ACSS2的活性不仅为这些细胞提供了维持效应基因表达的乙酰辅酶A,也通过支持组蛋白乙酰化,赋予TEXprog细胞更强的自我更新能力。这种能力使它们能够在免疫治疗中发挥关键作用。
然而,随着T细胞逐渐进入耗竭状态,ACSS2的表达显著下降,导致乙酸代谢的减少。与此相对,负责葡萄糖代谢的ACLY在终末型耗竭性T细胞(TEXterm)中依然活跃。ACLY通过将葡萄糖代谢物柠檬酸(citrate)转化为乙酰辅酶A,为这些细胞提供能量和代谢支持,但这一过程主要集中在抑制性基因表达上,限制了TEXterm细胞的功能恢复潜能。
实验数据显示,抑制ACLY或过表达核定位的ACSS2可以显著增强TEXprog细胞的比例,并提升其抗肿瘤功能。这表明,通过精准调控ACSS2和ACLY的表达或活性,能够影响T细胞的代谢选择和表观遗传状态,从而重新定义T细胞的命运路径。
这一发现不仅揭示了乙酰辅酶A在营养代谢与免疫调控中的核心作用,也为开发更高效的免疫治疗策略提供了新的突破口。
始祖与终末:耗竭性T细胞的两种命运路径
耗竭性T细胞(TEX)的功能命运可以分为两种截然不同的路径:具有自我更新能力的 始祖型 耗竭性T细胞(TEXprog)和功能基本丧失的 终末型 耗竭性T细胞(TEXterm)。这两种亚型不仅在表型和功能上各有特点,在抗肿瘤免疫中也发挥着不同的作用。
TEXprog是耗竭性T细胞中的关键 储备力量 。研究发现,这些细胞表达较低水平的抑制性受体(如PD-1)和较高水平的转录因子TCF-1。TCF-1赋予它们显著的增殖能力和应对免疫治疗的潜能。在免疫检查点抑制剂(ICB)治疗中,TEXprog能够迅速增殖并分化为效应型T细胞,为免疫系统提供持续的抗肿瘤效应。然而,TEXprog的比例有限,且在代谢和表观遗传调控不当时容易滑向终末型耗竭状态。
相比之下,TEXterm被视为 耗竭的终点 。这些细胞表达高水平的抑制性受体(如TIM-3和PD-1),功能完全受限,并失去了应对抗原刺激的能力。研究显示,TEXterm在表观遗传层面被显著重塑,其基因表达谱集中于抑制性途径。代谢研究进一步揭示,TEXterm对葡萄糖代谢(由ACLY调控)有更高的依赖性,而乙酸代谢(由ACSS2调控)的缺乏限制了它们的表观遗传灵活性。
实验中,通过抑制ACLY或促进ACSS2的活性,可以有效阻止TEXprog向TEXterm的转化,增强抗肿瘤免疫反应。这种代谢与表观遗传的精确调控为免疫治疗提供了重要线索。例如,靶向TEXprog细胞以维持其数量和活力,或重新激活TEXterm的功能潜力,可能显著提高免疫治疗的效果。
从乙酸到葡萄糖:代谢选择如何改变免疫应答?
T细胞的代谢模式不仅是其功能状态的反映,更是应对抗原持续刺激的适应性策略。CD8+ T细胞在从效应型(TEFF)向耗竭型(TEX)转变的过程中,其代谢路径发生了显著改变,这种代谢重塑直接影响了它们的抗原应答能力。
功能性TEFF细胞依赖于多样化的代谢方式,包括乙酸和葡萄糖代谢来维持乙酰辅酶A(acetyl-CoA)的生成。这种代谢灵活性使它们能够快速应对抗原刺激并产生高效的效应反应。然而,当抗原刺激持续存在时,T细胞逐渐转向耗竭状态,其代谢灵活性显著下降。研究显示,耗竭性T细胞的代谢路径逐步从乙酸利用转向以葡萄糖为主。这一转变与关键代谢酶的表达变化密切相关:ACSS2的表达在TEX细胞中显著下调,而负责葡萄糖代谢的ACLY则保持稳定甚至增强。
这种代谢选择的改变并非单纯的能量补偿,而是T细胞适应性调整的一部分。在长期抗原刺激下,葡萄糖代谢支持的乙酰辅酶A生成主要用于维持抑制性基因的表观遗传修饰,如终末型耗竭性T细胞(TEXterm)中高水平的TIM-3和PD-1表达。相比之下,乙酸代谢的减少则削弱了始祖型耗竭性T细胞(TEXprog)的自我更新能力,限制了其在免疫治疗中的潜能。
实验中,利用稳定同位素示踪技术进一步验证了这一代谢转变。研究发现,与TEFF细胞相比,TEX细胞的乙酸衍生的乙酰辅酶A显著减少,而葡萄糖来源的乙酰辅酶A比例增加。这种代谢特性的改变不仅是耗竭状态的标志,也成为干预T细胞功能的潜在靶点。
精准调控:代谢与表观遗传的交汇点
ACSS2和ACLY不仅是代谢酶,更是表观遗传调控的重要桥梁。它们通过组蛋白乙酰化直接影响特定基因的表达,塑造了T细胞的分化路径和功能状态。这种代谢与表观遗传的交汇点为理解耗竭性T细胞(TEX)的命运提供了关键视角。
ACSS2利用乙酸生成乙酰辅酶A(acetyl-CoA),其产物主要用于维持组蛋白乙酰化的高水平,尤其是始祖型耗竭性T细胞(TEXprog)中的效应性基因表达。例如,实验数据显示,ACSS2在TEXprog细胞中特异性定位于组蛋白乙酰转移酶p300的作用位点,促进了TEXprog标志性基因(如Tcf7和Bach2)的开放性染色质状态。这些基因的表达赋予TEXprog细胞强大的自我更新能力和潜在功能。
与之形成对比的是,ACLY通过将葡萄糖代谢物柠檬酸转化为乙酰辅酶A,支持终末型耗竭性T细胞(TEXterm)的组蛋白乙酰化。ACLY主要与组蛋白乙酰转移酶KAT2A协同作用,调控抑制性基因(如Havcr2和Il10)的表达。实验表明,ACLY依赖的乙酰辅酶A生成量足以维持染色质的局部开放性,但无法支持全局性的表观遗传调控,这解释了TEXterm细胞功能逐渐丧失的原因。
更为重要的是,ACSS2和ACLY的表达动态与T细胞分化阶段紧密相关。在慢性抗原刺激下,ACSS2的活性逐渐减弱,而ACLY的功能占据主导地位,推动TEX细胞向终末耗竭方向转化。然而,通过外源过表达核定位的ACSS2或抑制ACLY活性,可以重新激活TEXprog相关基因的表达,并有效提升T细胞的抗肿瘤功能。
新的免疫治疗希望
免疫治疗,如CAR-T细胞疗法和免疫检查点抑制剂(ICB),已经成为癌症治疗的重要突破。然而,T细胞耗竭(TEX)的存在限制了这些疗法的持久性和效果。该研究揭示的代谢与表观遗传调控机制,为优化这些疗法提供了新的方向。
在CAR-T疗法中,终末耗竭性T细胞(TEXterm)的比例增加是治疗失败的重要原因。研究表明,通过抑制ACLY或增强ACSS2的活性,可以显著减少TEXterm的形成,并增加始祖型耗竭性T细胞(TEXprog)的比例。这种策略可以延长CAR-T细胞的功能时间,增强其抗肿瘤效应。例如,将ACLY抑制剂(如BMS-303141)与CAR-T疗法联合使用,实验中显著降低了肿瘤相关抑制性基因的表达,同时提高了CAR-T细胞的抗肿瘤活性。
对于ICB疗法,如抗PD-1和抗PD-L1抗体,TEXprog是响应治疗的主要细胞亚型。然而,慢性抗原刺激导致ACSS2活性的下降,使得TEXprog比例减少,从而削弱了ICB的疗效。通过过表达核定位的ACSS2(ACSS2NLS),实验中观察到TEXprog细胞数量显著增加,且其增殖能力和功能也显著增强。这种基于代谢调控的策略与ICB疗法的结合,不仅提高了T细胞的功能恢复能力,还显著延缓了肿瘤生长。
此外,研究还证明ACLY和ACSS2的调控策略在小鼠模型和人类T细胞实验中均表现出显著一致性。这一发现为临床试验奠定了坚实基础,为患者提供了更精确、持久的免疫治疗希望。
未来,通过结合代谢调控与表观遗传干预,开发更高效、更精准的免疫治疗策略将成为可能。这一从实验室到临床的转化过程,为癌症和慢性疾病治疗开辟了新的篇章。
医药网新闻
- 相关报道
-
- 传奇科学家乔治·丘奇的抗衰老论文被撤稿!论文作者曾亲自“当小白鼠”,宣称年轻20岁 (2025-09-09)
- 《中药临盆监视治理专门规则》宣布 来岁3月1日起实施 (2025-09-09)
- 国度药监局对于宣布中药临盆监视治理专门规则的布告 (2025-09-09)
- Science:“毒”空气与痴呆的隐秘共谋——当PM2.5化身神经退行性疾病的“催化剂” (2025-09-09)
- 《细胞》子刊:芝加哥大学团队首次发现,玉米黄素竟能增强CD8阳性T细胞抗癌能力! (2025-09-09)
- 军事医学科学院×国防科技大学合作Cell子刊论文:AI从头设计广谱抗菌肽,同时对抗细菌和真菌 (2025-09-09)
- 为什么压力会让血糖升高?Nature研究揪出“幕后推手”:大脑杏仁核通过“神经专线”操控肝脏,2 型糖尿病风险与情绪脑有关 (2025-09-09)
- Cell:从110万年前猛犸象化石中发现最古老的宿主相关细菌DNA (2025-09-09)
- 业内子士山西太原聚焦生物医药行业牌号品牌维护 (2025-09-08)
- Nature:Cas9的“B面人生”——从基因剪刀到免疫记忆的调速器 (2025-09-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















