Nature子刊:揭示HIV |
 |
来源:100医药网 2025-01-22 11:32
这项研究不仅提供了HIV-1感染细胞翻译景观的详细图谱,还为治疗干预提供了丰富的潜在靶点。在一项新的研究中,来自亥姆霍兹RNA感染研究所和雷根斯堡大学的一个研究团队针对导致艾滋病的病毒HIV-1如何巧妙地劫持细胞机制以维持自身生存提出新的见解。通过剖析这种病毒与其宿主之间的分子相互作用,他们确定了HIV-1在抑制宿主细胞防御的同时确保其自身复制的新策略。
相关研究结果于2025年1月15日在线发表在Nature Structural Molecular Biology期刊上,论文标题为 The translational landscape of HIV-1 infected cells reveals key gene regulatory principles 。

HIV-1和其他病毒一样,缺乏产生自身蛋白的机制,必须依靠宿主细胞来翻译其遗传指令。进入宿主细胞后,它控制了翻译过程,将信使RNA(mRNA)转化为蛋白。
论文通讯作者Neva Caliskan说, 在这项研究中,我们结合了核糖体分析、RNA测序和RNA结构探测,以前所未有的细节绘制了这种病毒和宿主的翻译景观以及这种病毒复制过程中的暂停。
病毒翻译的欺骗代码
其中的一个关键发现是在HIV-1 RNA中发现了以前未被识别的序列元件,即上游开放阅读框(upstream open reading frame, uORF)和内部开放阅读框(internal open reading frame, iORF)。这些 隐藏的基因片段 可能在微调病毒蛋白的产生以及与宿主免疫系统的相互作用方面发挥关键作用。
论文第一作者、亥姆霍兹RNA感染研究所博士后研究员Anuja Kibe解释道, 例如,uORF和iORF可以作为调节因子,确保蛋白合成的精确时间和水平。
另一个重要发现是HIV-1病毒基因组中关键的 移码位点 附近的复杂RNA结构。这个移码位点对于这种病毒产生两种关键蛋白Gag和Gag-Pol的正确比例至关重要,毕竟这两种蛋白是组装感染性颗粒和HIV-1复制所必需的。
这些作者证实,这种延伸的RNA褶皱不仅促进了这个移码位点上游的核糖体碰撞 这似乎是一种调节翻译的机制 而且还保持了移框效率。
Caliskan报告说, 我们的团队还表明,用反义分子靶向这种RNA结构可以显著降低近40%的移码效率,为抗病毒药物开发提供了一条有前景的新途径。
论文共同作者Redmond Smyth说, 有趣的是,我们的分析表明,虽然HIV-1 mRNA在整个感染过程中有效翻译,但是这种病毒抑制宿主体内的蛋白产生,特别是在翻译起始阶段。
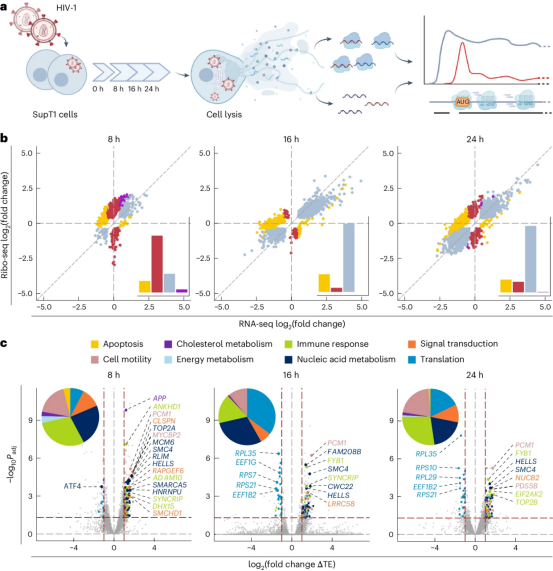
HIV-1感染细胞的全局转录和翻译变化
这使得HIV-1能够优先考虑自己的需求,同时有效地阻止宿主防御机制。因此,这种病毒可以以即使在压力条件下也保持强健的方式操纵宿主细胞机制。
这些作者还观察到核糖体在HIV-1 mRNA的特定区域碰撞,特别是这个移码位点的上游。论文共同作者Florian Erhard说, 这些碰撞并非偶然,而是受到严格调控的暂停,可能会影响核糖体与下游RNA结构的相互作用。
总体来说,这项研究不仅提供了HIV-1感染细胞翻译景观的详细图谱,还为治疗干预提供了丰富的潜在靶点。对HIV-1病毒复制至关重要的RNA结构和序列元件的鉴定为开发旨在破坏这些过程的药物提供了新的机会。
Caliskan补充道, 通过了解这种病毒如何巧妙地操纵我们的细胞,这些发现将使我们更接近创新的治疗方法,有朝一日可以扭转局面,战胜这种病毒本身。 (100医药网 100yiyao.com)
参考资料:
Anuja Kibeet al. .Nature Structural Molecular Biology, 2025, doi:10.1038/s41594-024-01468-3.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 构建中国人衰老时钟,200多位中国学者联合推出X-Age项目(耄耋计划),推动健康长寿研究 (2025-09-11)
- 参天公司青光眼引流器"港澳药械通"上市许可获广东省药监局批准 (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















