《自然·通讯》:复旦大学附属肿瘤医院团队发现肿瘤肝转移灶的“守护神”! |
 |
来源:奇点糕 2025-02-21 10:20
接受免疫治疗的结直肠癌肝转移患者外周血WNT11水平与疗效显著相关,未来或可通过无创检测WNT11提早预测疗效、指导治疗。近日,复旦大学附属肿瘤医院赵森林、李大卫等研究者在Nature Communications期刊发表了最新研究成果,揭示灶中的可借助过表达转录因子WNT11,同时影响CD8+T细胞的募集、激活和抑制性巨噬细胞的极化,从而实现免疫逃逸和对PD-1抑制剂治疗的耐药,因此WNT11有望成为免疫治疗针对肝转移灶时的疗效预测标志物,它和下游作用分子CAMKII也可成为干预靶点[1]。
看名字也能看出,WNT11是主要影响WNT信号通路的转录因子家族成员之一,而WNT/ -Catenin通路的激活可在多种实体瘤中导致免疫排斥[2]。研究者们还注意到,在2023年发表的一项肝转移灶多组学研究[3]中,WNT通路激活也与肝转移灶CD8+T细胞浸润减少显著相关,那当然要深入分析一下具体影响免疫浸润的是WNT通路中的哪个家伙。
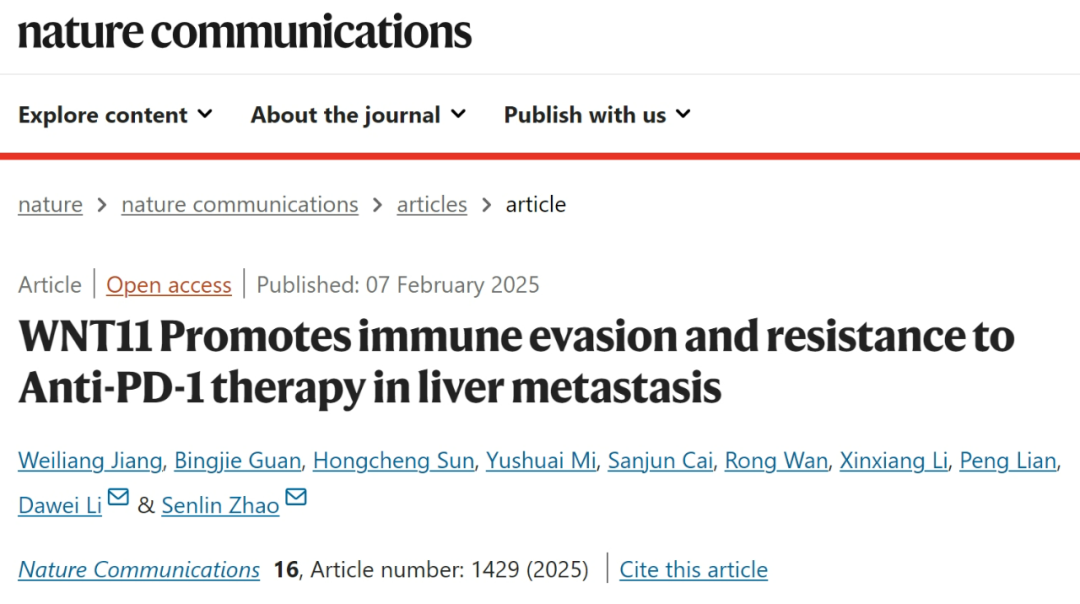
对既往研究数据的再分析首先显示,WNT11表达水平与肝转移患者的生存预后负相关,而受 -Catenin调控的转录因子AFF3表达水平则与患者生存预后正相关,且WNT11和AFF3二者的表达水平也呈负相关,而WNT11低表达/AFF3高表达肿瘤中的CD8+T细胞浸润相对较多;研究者们又改用本院/肝转移患者队列数据证实,患者肝转移灶内的WNT11表达水平均高于原发灶,AFF3表达水平则低于原发灶。
WNT11表达水平与肝转移灶患者不良预后和CD8+T细胞浸润相关
从以上数据来看,WNT11及下游被它在转录水平调控的AFF3确实对肝转移灶免疫浸润有重要影响。研究者们又将敲低WNT11表达的癌细胞注射至小鼠体内,证实癌细胞形成肝转移灶的能力显著减弱,转移灶内CD8+T细胞浸润也相应增多,对PD-1抑制剂治疗应答更好,但前提都是小鼠免疫系统健全,说明WNT11的调控发生在微环境层面。
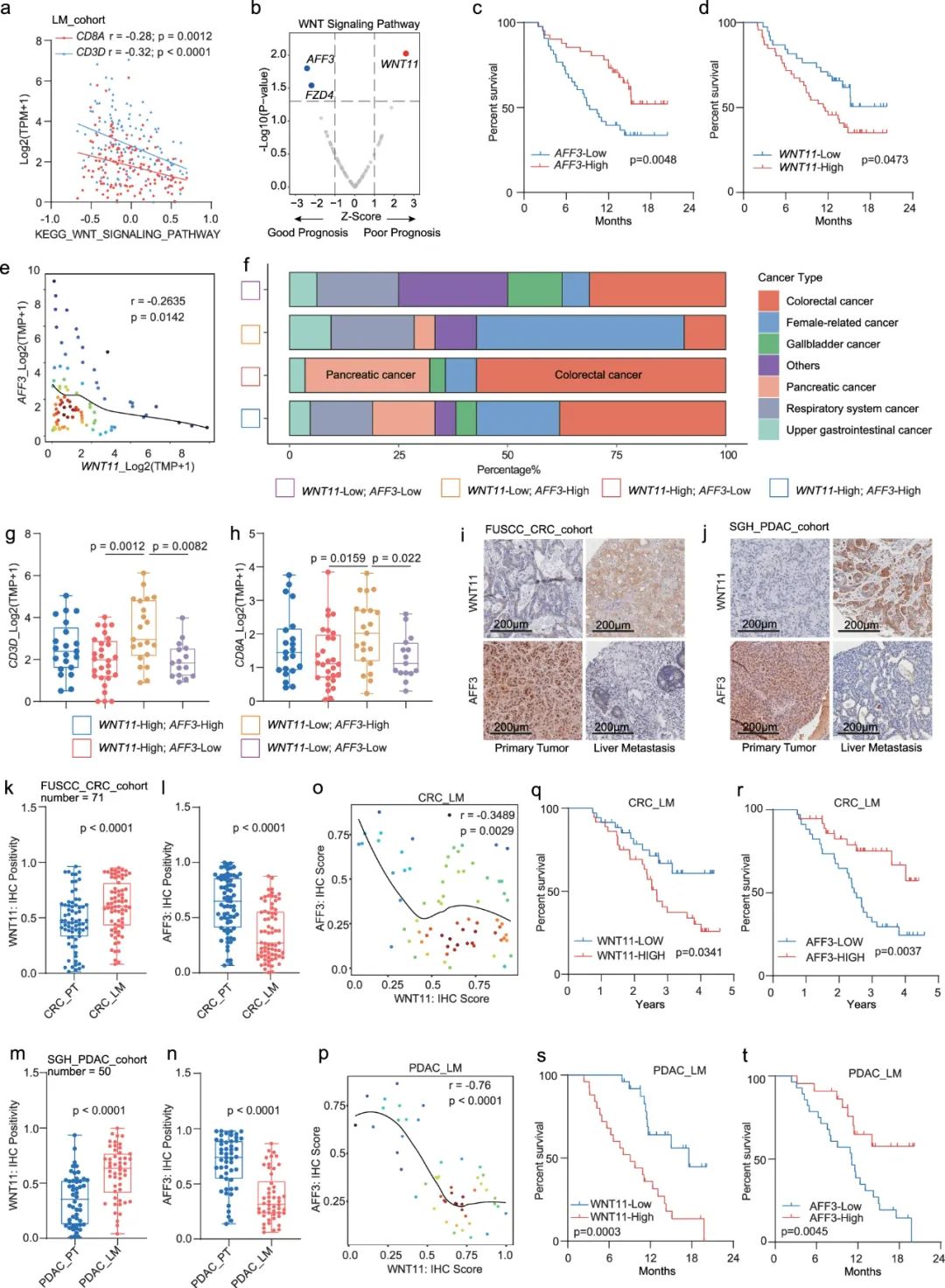
敲低癌细胞WNT11表达后,肿瘤微环境内变化最明显的免疫细胞有两种,一种就是浸润增多的CD8+T细胞,另一种则是以表达CD206为特征的免疫抑制性巨噬细胞,这对应了表达WNT11癌细胞调控CD8+T细胞的直接和间接途径,而在两条途径中率先响应WNT11的,都是非经典WNT信号通路中的钙离子/钙调蛋白依赖激酶II(CaMKII)。
敲低癌细胞WNT11表达,会影响瘤内CD8+T细胞和CD206+免疫抑制性巨噬细胞数量
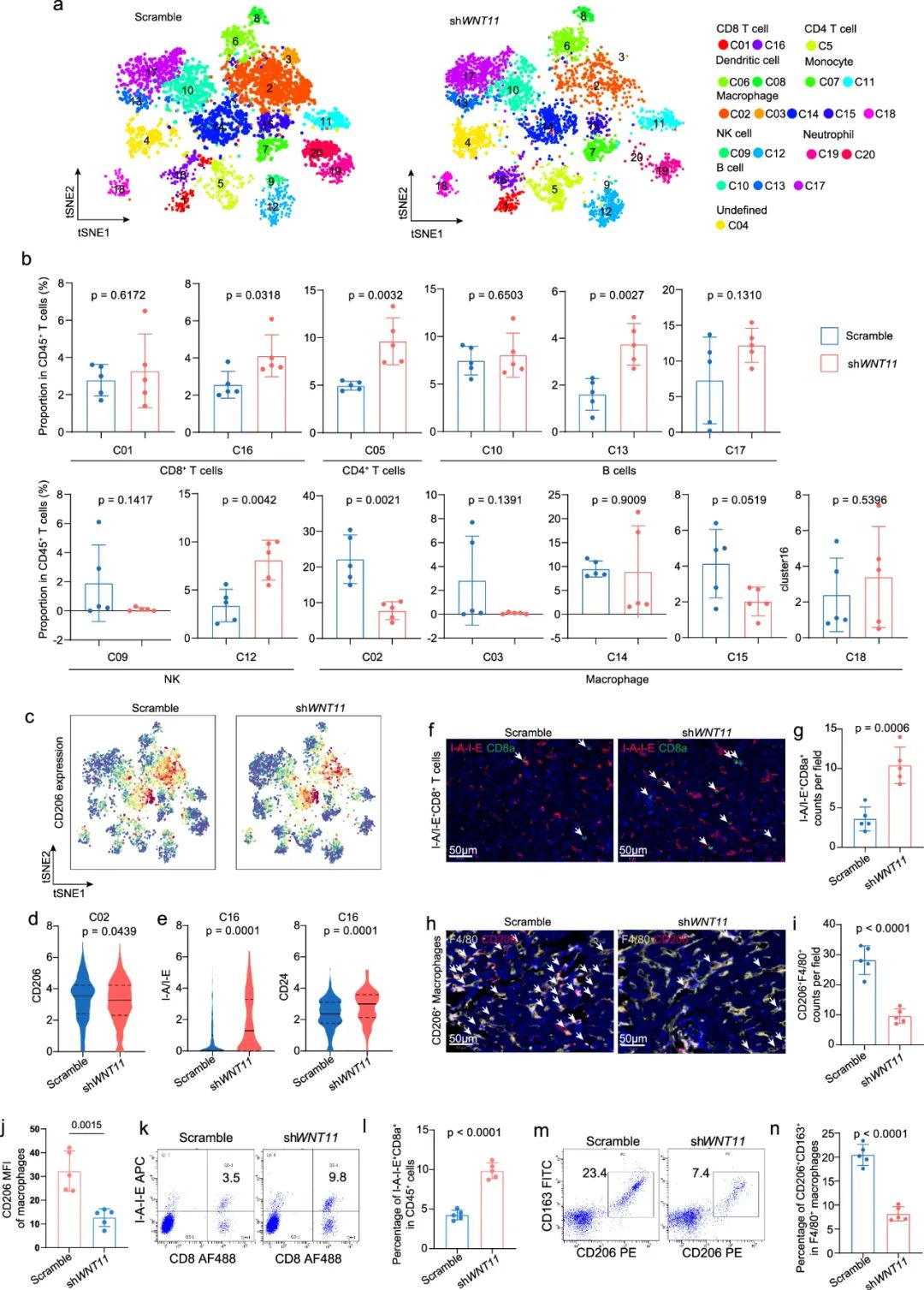
先说直接途径:WNT11激活CaMKII会抑制AFF3表达,也是前面提到WNT11和AFF3二者表达水平负相关的原因,而AFF3表达的下调则会降低CXCL10、CCL4两种调控CD8+T细胞激活和抗肿瘤免疫功能的趋化因子编码基因表达,使CD8+T细胞无法有效抑癌。而在间接途径上,WNT11则会激活CaMKII/NF- B通路来上调细胞因子IL17D表达水平,进而通过IL17D与其受体CD93信号轴,调控巨噬细胞向免疫抑制性M2表型极化。
这样 两头堵 之下,WNT11就帮助肝转移灶癌细胞实现了免疫逃逸,PD-1抑制剂治疗的效果也大打折扣,而使用在研的CaMKII拮抗剂即可逆转WNT11的不利影响,与免疫治疗实现协同增效。最后研究者们也确认,接受免疫治疗的结直肠癌肝转移患者外周血WNT11水平与疗效显著相关,未来或可通过无创检测WNT11提早预测疗效、指导治疗。
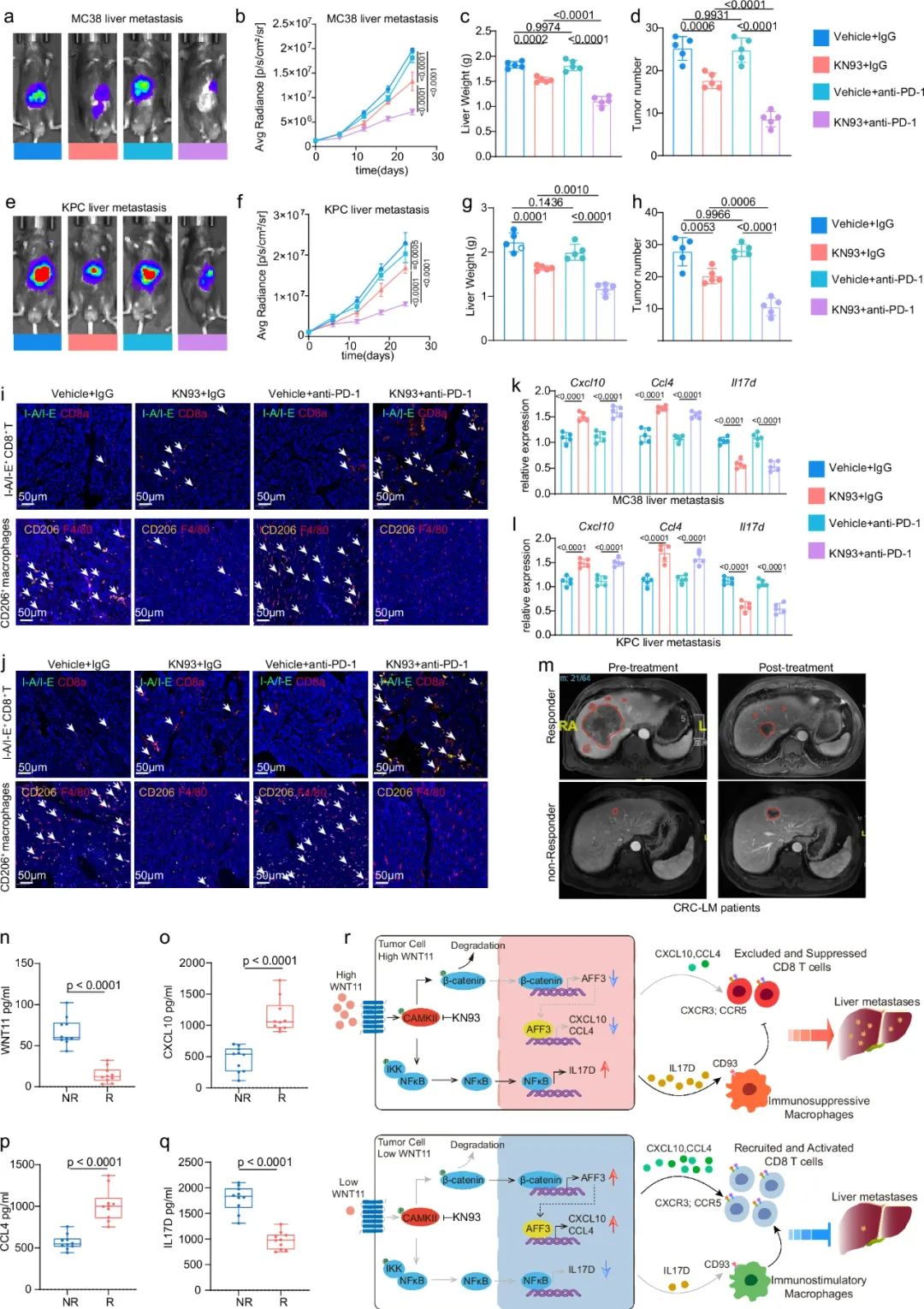
使用在研CaMKII拮抗剂的效果疗效及研究发现汇总
参考文献:
[1]Jiang W, Guan B, Sun H, et al. WNT11 Promotes immune evasion and resistance to Anti-PD-1 therapy in liver metastasis[J]. Nature Communications, 2025, 16: 1429.
[2]Luke J J, Bao R, Sweis R F, et al. WNT/ -catenin pathway activation correlates with immune exclusion across human cancers[J]. Clinical Cancer Research, 2019, 25(10): 3074-3083.
[3]Yang S, Qian L, Li Z, et al. Integrated multi-omics landscape of liver metastases[J]. Gastroenterology, 2023, 164(3): 407-423. e17.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- “脂质溢出”是元凶?10月30日直播预告:揭秘肥胖代谢共病背后的真相 (2025-10-27)
- Science:我国科学家揭示人类跳跃基因LINE-1靶向结构化DNA来重塑基因组 (2025-10-27)
- 警惕“超级大肠杆菌”!它堵死肠道细胞“自我牺牲路”,新研究破解抗耐药密码 (2025-10-27)
- Nature Genetics:我们沿用20年的小鼠参考基因组,究竟错过了什么?一份T2T图谱的完整答案 (2025-10-26)
- 情感传染!南方医科大学最新论文登上Science封面 (2025-10-26)
- Nature Biotechnology:数据基准与算法创新的双轮驱动——DeepSomatic研究定义的基因组学发现新范式 (2025-10-25)
- Nature:当饥饿遇上荷尔蒙——大脑如何权衡母爱与生存? (2025-10-25)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 《柳叶刀》:减肥神药,暗藏护心秘法!迄今最大规模临床试验证实,司美格鲁肽的心脏保护作用与基线肥胖和体重减轻无关,或有独特保护机制 (2025-10-24)
- Cell子刊:脂肪细胞脂解,激活上皮干细胞,促进毛发再生 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















