两款重磅新药将迎来FDA咨询委员会审判 |
 |
来源:医药魔方 2025-07-01 13:16
如果能够通过PDAC的考验并获得FDA的首肯,布瑞哌唑+舍曲林将成为20多年来第一个获得FDA批准的PTSD治疗药物。这场会议将是PTSD领域的关键一战。7月中旬,美国咨询委员会将连续召开两场关键会议,这将决定两款重磅药物 belantamab mafodotin和布瑞哌唑的命运,也是改写治疗格局的关键 审判 。
这两款药物分别代表了血液肿瘤和精神健康领域的重要突破,前者是领域首款ADC药物,后者有望成为20余年来首个批准的PTSD治疗新药。
BCMA ADC冲击多发性骨髓瘤二线治疗
7月17日,FDA肿瘤药物咨询委员会将讨论GSK提交的belantamab mafodotin生物制品许可申请(BLA),用于与硼替佐米和地塞米松联合治疗既往至少接受过一种治疗的多发性骨髓瘤(MM)患者;以及与泊马度胺和地塞米松联合治疗既往至少接受过一种治疗(包括来那度胺)的MM患者。

Belantamab mafodotin是一款first-in-class的BCMA抗体偶联药物(ADC),由人源化抗BCMA单克隆抗体和细胞毒药物auristatin F通过不可切割的连接子偶联而成。该药最初由Seagen(已被辉瑞收购)开发,2009年12月,GSK与Seagen达成协议,获得该药物的研究、开发、生产和商业化权益。
2020年8月,基于II期DREAMM-2研究结果(主要终点为ORR),belantamab mafodotin先后获得FDA和EMA的加速批准和附条件批准,用于单药治疗既往接受过至少4种治疗(包括抗CD38单抗、蛋白酶体抑制剂和调节剂)的复发性或难治性MM成年患者。
不过,因评估belantamab mafodotin单药vs泊马度胺联合低剂量地塞米松(PomDex)治疗既往接受过至少两种治疗的复发或难治性MM患者疗效的验证性III期DREAMM-3研究未能达到PFS主要终点,GSK已分别于2022年和2023年在美国和欧盟撤回该药已获批的适应症()。
为探索belantamab mafodotin作为MM二线治疗方案的应用潜力,GSK开展了两项III期研究(DREAMM-7和DREAMM-8)。这两项研究已分别于2023年和2024年达到主要终点。
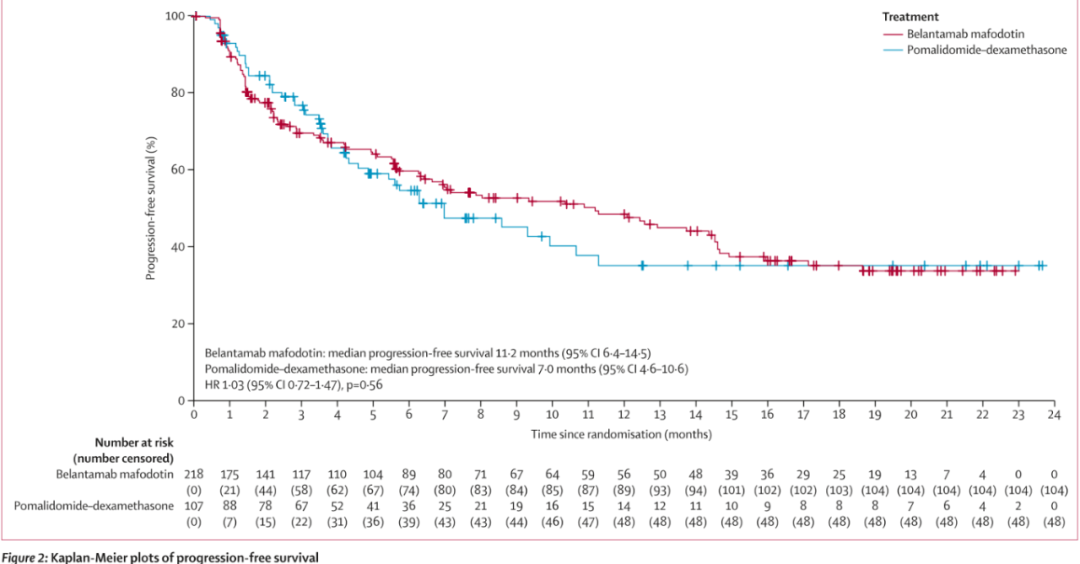
DREAMM-7研究旨在评估belantamab mafodotin联合硼替佐米与地塞米松(BorDex)vs. 强生的CD38单抗达雷妥尤单抗联合BorDex方案在复发或难治性多发性骨髓瘤二线及后线治疗中的疗效。结果显示,在PFS的主要终点中,与对照组(n=251)相比,belantamab mafodotin联合治疗组(n=243)观察到具有学意义和临床意义的改善,疾病进展或死亡风险降低了59%。中位随访时间为28.2个月,belantamab mafodotin联合治疗组的中位PFS为36.6个月,而达雷妥尤单抗联合治疗组为13.4个月。也就是说,belantamab mafodotin联合治疗相较于标准疗法延长了近3倍PFS。
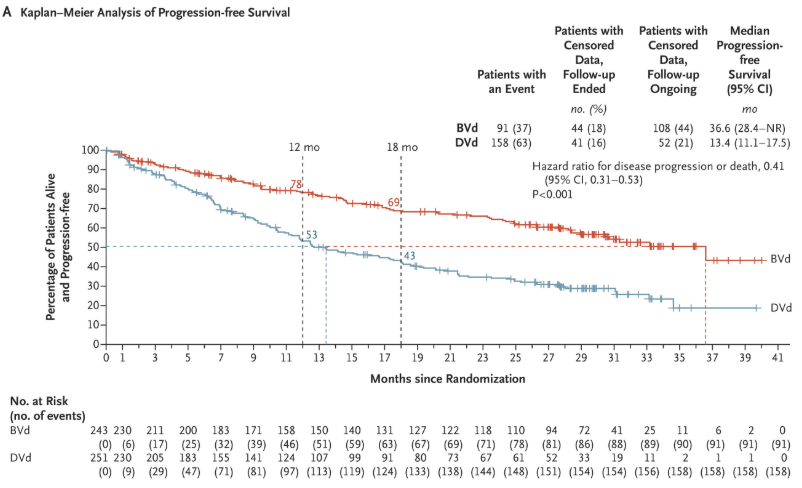
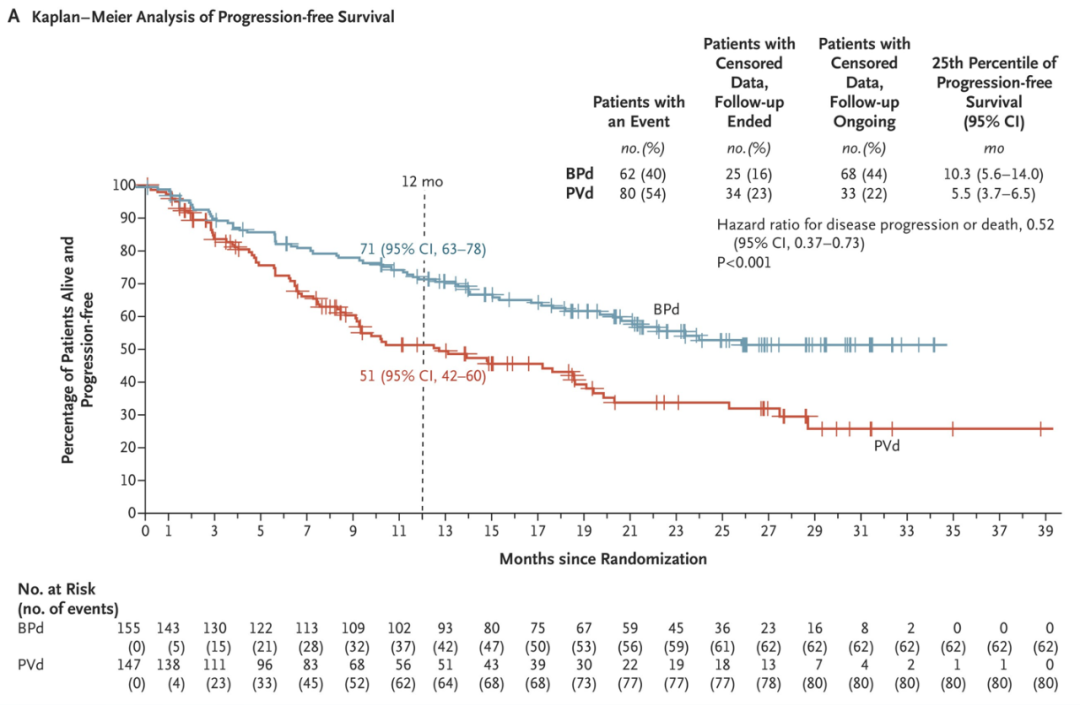
DREAMM-8研究旨在评估belantamab mafodotin联合泊马度胺与地塞米松(BPd)与硼替佐米联合泊马度胺与地塞米松方案(PVd),作为复发性或难治性MM的二线和后期疗法的疗效与安全性。中位随访21.8个月,BPd组的中位PFS未达到,而PVd组为12.7个月,HR为0.52。在12个月时,BPd组的PFS率为71%,PVd组为51%。
PTSD领域的关键一战
7月18日,FDA精神药物咨询委员会(PDAC)将召开会议讨论Rexulti(布瑞哌唑片剂)联合舍曲林用于治疗后应激障碍(PTSD)成人患者的补充新药申请(sNDA)。
布瑞哌唑是Otsuka Pharmaceutical研发的一种5-HT1A受体部分激动剂、5-HT2A受体拮抗剂、多巴胺D2受体部分激动剂。2011年11月,灵北(Lundbeck)与大冢制药达成总额高达18亿美元的协议,获得布瑞哌唑的全球合作开发和商业化权益。2015年7月,布瑞哌唑首次在美国获批上市,用于治疗重度(MDD)或精神分裂症。2023年5月,布瑞哌唑的适应症进一步扩大至激越。
本次sNDA是基于三项随机临床试验(Trial 061、Trial 071、Trial 072)的数据。这三项试验的主要终点是根据《精神障碍与统计手册》第五版(DSM-5)诊断为PTSD的患者从随机化(第1周)到第10周的临床医生的PTSD量表(CAPS-5)总分的变化。
Trial 061是一项II期临床试验(n=321),评估了布瑞哌唑(1-3mg/天,灵活剂量) 舍曲林(100-200mg/天)对比舍曲林单药或安慰剂的疗效和安全性。结果显示,布瑞哌唑+舍曲林组患者的CAPS-5总分较其他组明显下降(-16.4分),布瑞哌唑单药组、舍曲林单药组、安慰剂组的CAPS-5总分分别降低了12.2分、11.4分、10.5分。
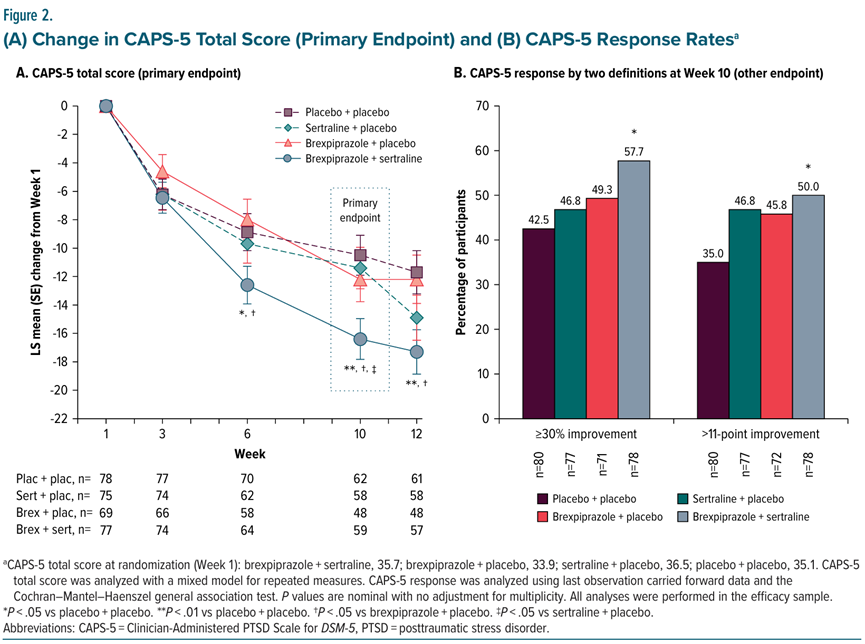
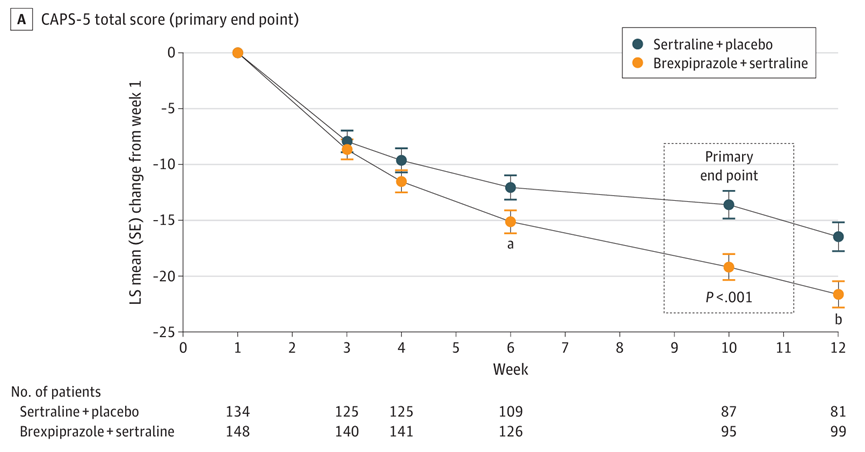
Trial 071是一项III期临床试验(n=416),评估了布瑞哌唑(2-3mg/天,灵活剂量)+舍曲林(150mg/天)对比舍曲林+安慰剂的疗效和安全性。结果显示,布瑞哌唑+舍曲林组患者的CAPS-5总分较舍曲林+安慰剂组显著下降(-19.2分 vs -13.6分,LS平均差为-5.59,P 0.001)。
Trial 072是一项III期临床试验(n=591),评估了布瑞哌唑(2-3mg/天,固定剂量)+舍曲林(150mg/天)对比舍曲林单药的疗效和安全性。结果显示,该研究未达到主要终点,但布瑞哌唑+舍曲林对PTSD症状的减轻趋势(-18.3分 vs -17.6分,P=0.66)与Trial 061和Trial 071一致。
三项随机试验表明,布瑞哌唑+舍曲林治疗PTSD成人患者总体耐受性良好,未发现新的安全性观察结果。安全性和耐受性结果与布瑞哌唑在其已批准适应症中的已知特征以及在其他临床试验中观察到的情况一致。合并分析数据显示,布瑞哌唑+舍曲林组的治疗期间不良事件(TEAE)总体发生率为55.5%,舍曲林+安慰剂组为56.2%。常见的TEAE包括恶心、头痛、体重增加和腹泻。
PTSD是一种经历过或目睹创伤事件或情景的人易患的精神疾病,是美国最常见的心理健康障碍之一。据统计,美国每年大约有1300万例PTSD患者,大约有6%的美国人会在生命中的某个时刻确诊PTSD。
目前,仅舍曲林和帕罗西汀获批为PTSD的治疗药物,但这类药物治疗PTSD的有效率低于60%,完全缓解率不到20%-30%。此前也有其他药物走至申报上市阶段,即MDMA(亚甲二氧甲基苯丙胺),但该药物遭到PDAC的强烈质疑,最终被FDA否决()。
如果能够通过PDAC的考验并获得FDA的首肯,布瑞哌唑+舍曲林将成为20多年来第一个获得FDA批准的PTSD治疗药物。这场会议将是PTSD领域的关键一战。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 5年生存率不足10%,“癌王”难治的原因找到了!《自然》子刊发现它们有特殊入侵方式 (2025-10-02)
- Science:迄今最大规模人类蛋白互作图谱发布!系统鉴定了17849组高置信度蛋白互作,其中3631组为全新首次发现 (2025-10-02)
- Nat Neurosci: 激素调控月经周期中的全脑结构动态 (2025-10-02)
- Adv Sci:空军军医大学黄静等人研究阐明ACC依赖机制连接牙颌结构异常与慢性疼痛-情绪共病 (2025-10-02)
- 长寿可以遗传?《科学》研究发现某些优势或能传到第四代 (2025-10-02)
- Nat Commun:南方医科大学张先荣研究发现巨噬细胞双调蛋白诱导脓肿附近脂肪前体细胞肌成纤维细胞转变 (2025-10-02)
- Nature:新研究鉴定出蛋白LRP8是蜱传脑炎病毒入侵人类脑细胞的受体 (2025-10-02)
- PNAS:金浩杰团队等揭示癌症靶向治疗新策略——靶向VCP,“诱导+清除”衰老细胞双管齐下 (2025-10-01)
- 《自然》:科学家发现,无精氨酸/脯氨酸饮食联合二氟甲基鸟氨酸,可让神经母细胞瘤翻译停滞,提升疗效 (2025-10-01)
- Cell:细菌可将对过去环境的记忆代代相传 (2025-10-01)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















