糖尿病治愈新希望:CRISPR基因编辑细胞在人体内分泌胰岛素,且无需使用免疫抑制药物 |
 |
来源:生物世界 2025-09-06 14:07
研究人员使用 CRISPR-Cas12b 基因编辑了来自捐赠者的胰岛 β 细胞以避免排斥反应,并将这些细胞注射移植到一名患有 1 型糖尿病的男性患者前臂肌肉中,且患者未接受任何免疫抑制药物。2025 年 8 月,国际顶尖医学期刊《新英格兰医学杂志》(NEJM)发表了一篇重磅论文:Survival of Transplanted Allogeneic Beta Cells with No Immunosuppression(无需抑制的同种异体胰岛 细胞移植存活)。
在异体细胞移植后,需要抑制患者的免疫系统,而这会带来广泛的副作用。在这项研究中,研究人员使用CRISPR-Cas12b基因编辑了来自捐赠者的胰岛 细胞以避免排斥反应,并将这些细胞注射移植到一名患有1 型的男性患者前臂肌肉中,且患者未接受任何免疫抑制药物,移植后 12 周内,未出现对这些基因编辑细胞的免疫反应,这些细胞在体内稳定且持续分泌着调控血糖的胰岛素。

这项研究由 Sana Biotechnology 公司主导开展,为 1 型糖尿病(T1D)这种自身免疫疾病带来了持久治愈的希望。这种疾病是因为免疫系统中的 T 细胞错误攻击分泌胰岛素的胰岛中的 细胞,导致胰岛功能丧失。在班廷发现并利用胰岛素之前,1 型糖尿病是不治之症,但直到现在,这种疾病患者仍不得不终生严格监测血糖并每天多次注射胰岛素,但即便如此,他们仍面临着昏迷风险。
目前,对于 1 型糖尿病患者来说,避免依赖注射胰岛素的唯一方法是移植捐赠者(死者)的胰岛细胞。该手术可使胰岛素分泌恢复数年,但实际上这种方法很少实施,因为细胞来源稀缺,还需要终身使用免疫抑制药物,而长期使用免疫抑制药物存在感染、癌症以及其他严重副作用的风险。
为解决细胞来源短缺问题,一些公司已转向利用技术在实验室中生成无限量的胰岛替代品。
其中,Vertex公司进展最快。今年 6 月,该公司在《新英格兰医学杂志》(NEJM)发表了一篇论文:Stem Cell Derived, Fully Differentiated Islets for Type 1 Diabetes(干细胞来源的完全分化胰岛,用于1 型),将胚胎干细胞分化而来的胰岛(未进行基因编辑)移植到了 12 名 1 型糖尿病患者体内,1 年后,其中有 10 名患者不再需要注射胰岛素,该公司计划在明年申请该细胞疗法上市。
在中国,北京大学邓宏魁教授创立的瑞普晨创(Reprogenix)公司同样取得了初步成功,他们使用化学重编程技术,将患者自身脂肪细胞重编程并再分化为胰岛,移植到1 名 1 型糖尿病患者的腹直肌前鞘下,患者在 1 年随访中不再需要注射,且恢复了血糖控制。该研究于 2024 年 9月 发表于Cell期刊【3】。
但Vertex和瑞普晨创的细胞疗法,都需要患者使用免疫抑制药物,前者是防止患者免疫系统对异体细胞的攻击,后者是为了对抗免疫系统对自身细胞的自身免疫攻击。
而Sana公司则尝试通过基因编辑技术帮助患者不再使用免疫抑制药物。他们从一名没有糖尿病的已故捐赠者身上获取了胰岛细胞,然后使用CRISPR-Cas12b基因编辑系统,敲除了这些细胞上的HLA I和HLA II,防止免疫系统识别和杀伤外来细胞;并通过慢病毒载体在细胞中过表达了CD47蛋白,CD47 作为一种 别吃我 (do not eat me)信号,能够防止巨噬细胞和 NK 细胞吞噬和攻击。
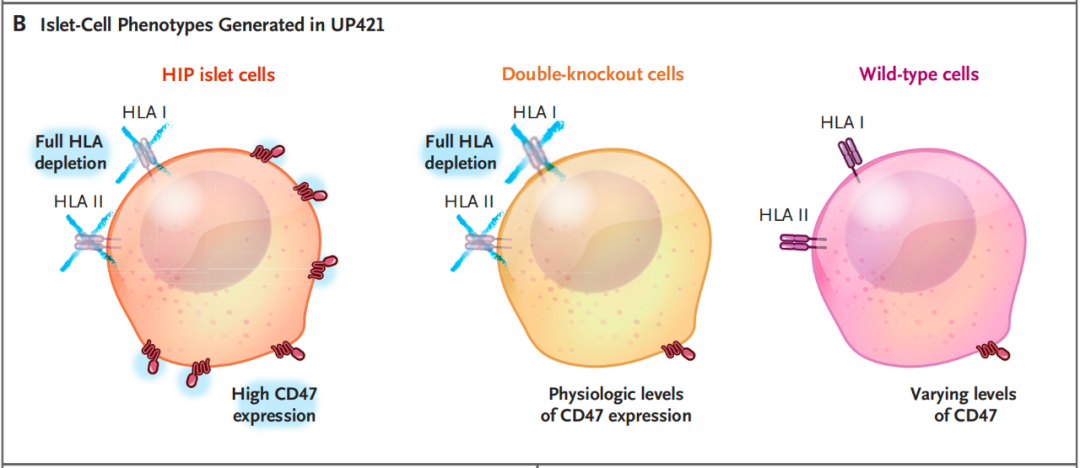
然后,研究团队对一名 42 岁、病程 37 年且血糖控制不佳的 1 型糖尿病患者进行了治疗,向他的手臂肌肉中注射了约 8000 万个经过基因编辑的细胞(这是特意设定的低剂量,以进行安全性测试)。结果显示,这些基因编辑的细胞能够在患者体内存活,在无需使用免疫抑制药物的情况下不会被免疫系统清除,并在 12 周时间内稳定且持续产生胰岛素。后续报告显示,这些细胞在患者体内持续存活了 6 个月。
这些经过基因编辑的细胞 真正克服了移植障碍 ,是朝着实现治愈 1 型糖尿病这一长期愿景迈出的重要一步。在将来有望实现 一次治疗、终生有效,无需注射胰岛素,也无需免疫抑制药物。
这种研究的终极目标是将这些可实现 免疫隐身 的基因编辑应用于干细胞,然后引导其发育为分泌胰岛素的胰岛细胞。据悉,Vertex、Sana 以及其他几家公司正沿着这条道路前行,最早将于明年开展人体临床试验。
不过,有一些独立的研究团队对Sana 公司的这种 免疫隐身 策略提出了疑问,他们未能重复出 CD47 的保护效果。此外,Sana 的研究只有一位患者参与,患者注射的细胞数量低(约 8000 万个)且时间短(12 周),实际临床疗效仍有待证实。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cancer Cell:肿瘤内细菌,驱动癌症治疗耐药性 (2025-10-19)
- 哈医大最新研究登上Cell头条:从多组学视角揭示不同器官系统的衰老差异 (2025-10-18)
- Nature Biotechnology:FUGAsseM利器出鞘——一种基于微生物群落共表达的功能预测新范式 (2025-10-18)
- Cell:西湖大学卢培龙团队等首次从头设计出电压门控离子通道,在体内抑制神经元电活动 (2025-10-18)
- Cell子刊:毕楠/崔明/葛红等人揭示肠道菌群可预测肺癌巩固免疫治疗效果及放化疗毒性 (2025-10-17)
- Neuron:高郑润/徐天乐/吴逸雯等揭示中风后情绪障碍的新机制 (2025-10-17)
- Nature系列综述:西湖大学董晨院士系统总结CD8⁺T耗竭的调控因子 (2025-10-16)
- 由趋势观前沿:毕马威正式发布第三届生物科创领航50企业报告 (2025-10-15)
- 从“假基因”到“致病元凶”!Brain新研究:SSPOP基因复合杂合突变诱发儿童癫痫,多模型证实其功能与致病机制 (2025-10-15)
- Science:“吃不胖”的免疫学新解——T细胞胆固醇稳态是决定膳食脂肪吸收的关键 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















