JITC:苏大三附院团队 揭开肿瘤微环境中免疫抑制性T细胞增多之谜! |
 |
来源:奇点蛋糕2022-11-07 17336039
本研究揭示了TME Treg上的IL1R2在增强免疫抑制中的关键作用,发现Treg上的IL1R2可以通过阻断IL1信号增加CAF上MHC-II的表达,从而增强CAF和Treg之间的相互作用。
调节性T细胞(Treg)对于维持机体稳态和避免免疫损伤至关重要,但Treg也会阻碍机体的抗肿瘤免疫反应。
组织特异性自身抗原在将Treg募集到肿瘤中发挥重要作用,但在肿瘤微环境(TME)中调节Treg聚集的自身抗原的性质和来源仍不清楚。
研究表明,肿瘤相关成纤维细胞(CAF)可以募集Treg,抑制抗肿瘤免疫反应[1,2]。甚至一些CAF表达MHC-II,可以抑制CD4 T细胞介导的免疫反应[3]。然而,CAF呈递的抗原肽能否刺激和维持肿瘤浸润性Treg细胞尚不清楚。
近日,苏州大学第三附属医院蒋敬亭领导的研究团队在《肿瘤免疫治疗杂志》发表了该研究成果[4]。
他们发现,IL-1可以抑制MHC-II和抗原呈递相关基因在CAF中的表达,而TME的Treg高表达IL-1诱饵受体IL1R2,可以剥夺CAF的IL-1信号,促进CAF表达MHC-II,增强其呈递自身抗原的能力,进而增加肿瘤浸润Treg的数量。敲除Treg中的IL1R2可以减少肿瘤浸润Treg的数量,增加CD8 T细胞的浸润,促进抗肿瘤免疫反应。
这项研究表明,阻断IL1R2可能是一种有效的抗肿瘤免疫治疗策略。

报纸首页截图
IL1是一种强有力的促炎细胞因子,其功能在体内受到严格限制。IL1R2是IL1的诱饵受体,能与IL1结合并抑制其与IL1功能性受体IL1R1的结合。一些研究发现,肿瘤浸润的Treg细胞高表达IL1R2[5],但目前,其功能尚未完全了解。
为了探索IL1R2在抗肿瘤免疫中的作用,研究小组通过单细胞转录组测序和流式细胞术分析了IL1R2在肿瘤浸润性T细胞(t IL)中的表达,发现IL1R2主要在小鼠和人TIL的Treg细胞中表达。
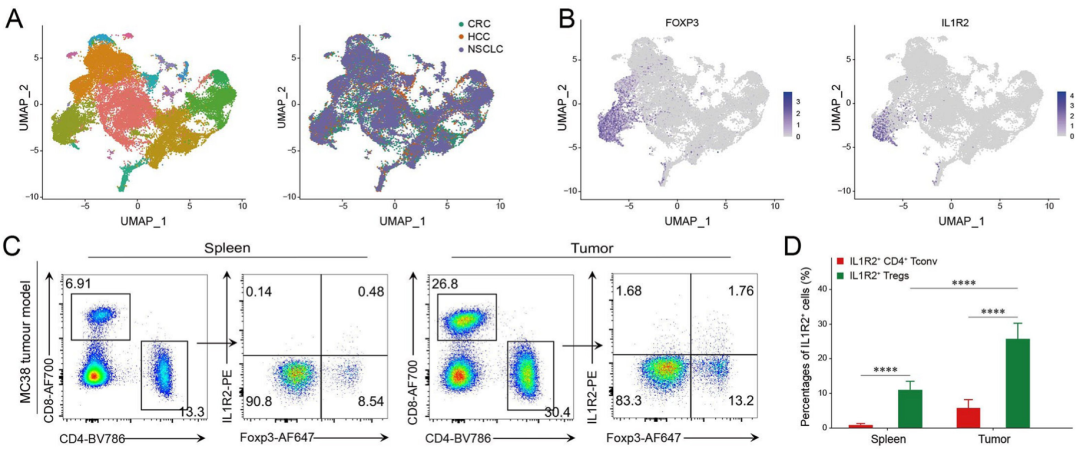
IL1R2主要在肿瘤浸润性Treg细胞中表达。
为了探索IL1R2在Treg细胞中的功能,研究小组使用了Treg特异性IL1R2敲除小鼠(以下简称cKO小鼠)模型。
cKO小鼠和野生型(WT)小鼠接种结肠癌细胞系MC38后,两组小鼠的肿瘤生长率基本相同,但接受抗PD-1抗体或抗CTLA-4抗体后,cKO小鼠的肿瘤生长率明显低于WT小鼠。
这些数据表明,在敲除Treg细胞上的IL1R2后,小鼠对免疫检查点抑制剂治疗更加敏感。
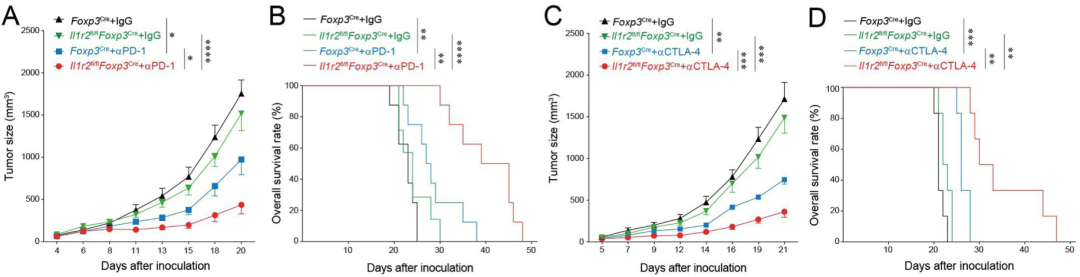
敲除Treg上的IL1R2增强了免疫检查点抑制剂的功效。
那么,在Treg上淘汰IL1R2之后,TME发生了什么?
为了知道这个问题的答案,研究小组使用流式细胞仪检测了TIL中的细胞比例,发现敲除Treg细胞的IL1R2后,用免疫检查点抑制剂治疗的小鼠TME中的CD8 T细胞数量显著增加,而Treg的数量显著减少。这表明敲除Treg中的IL1R2后,小鼠的抗肿瘤免疫能力增强,这种增强可能与Treg数量减少有关。
这些数据表明,Treg上的IL1R2在维持TME Treg的数量中起重要作用。

在Treg上敲除IL1R2后,在用-PD1治疗的小鼠的TME中,CD8 T细胞增加,Treg减少。
由于IL1R2可以阻断IL1信号转导,研究小组想知道TME哪些细胞表达IL1的功能受体IL1R1。这些细胞最有可能受到Treg上表达的IL1R2的影响。
研究小组分析了MC38全肿瘤细胞。
细胞转录组测序数据,发现IL1R1主要表达在CAF以及少数血管内皮细胞(EC)上。这提示CAF可能是IL1R2在TME中的靶标。进一步的分析发现,在WT小鼠TME中存在两类CAF 促炎性CAF(iCAF)和抗原递呈CAF(apCAF),而在cKO小鼠TME中,apCAF基本消失。比较WT小鼠和cKO小鼠TME中CAF的差异表达基因发现,cKO小鼠CAF中MHC-II以及抗原递呈相关基因显著下调,这与apCAF消失也是相符的。
这些数据表明,Treg上的IL1R2可以影响CAF的表型,尤其是影响其MHC-II类基因的表达;同时cKO小鼠TME中CAF上MHC-II基因下调也表明,CAF与CD4+T细胞的相互作用会减少。研究团队猜想,这些变化可能是由于Treg剥夺了TME局部IL1信号,而IL1信号可能会抑制CAF中MHC-II以及抗原递呈相关基因的表达。
为了验证上述猜想,研究团队进行了体外实验研究,他们发现IFN- 可以显著上调成纤维细胞的MHC-II与PD-L1表达水平,而当IFN- 与IL-1 同时刺激成纤维细胞时,MHC-II显著降低。这些数据表明,IL1信号可以直接抑制成纤维细胞上MHC-II的表达,与之前的猜想一致。
综合上述结果可知,Treg上的IL1R2可以抑制CAF上的IL1/IL1R1信号轴,从而避免CAF中MHC-II的表达被IL-1 抑制,从而增强CAF与CD4+T细胞(包括Treg)相互作用的能力,进而增加TME中Treg的数量。

Treg上的IL1R2限制CAF上的IL1/IL1R1信号,上调CAF中MHC-II表达
已有研究表明,在TME中CAF可以招募、诱导Treg细胞,诱导免疫抑制[6]。结合上述结果,研究团队想知道,CAF中MHC-II表达降低是否会影响TME中Treg的功能。
为了知道这个问题的答案,研究团队进行了单细胞转录组测序以及分析,发现在TME中的Treg可以分为preTreg(未活化的Treg)、eTreg(效应Treg)、iTreg(干扰素诱导的Treg)和HyprTreg(超强Treg)四群,而敲除Treg上的IL1R2后,肿瘤中Treg的分群并未发生明显的变化。
Treg细胞在外周组织中活化并开始发挥抑制功能时会进行增殖,由同一个Treg细胞(或拥有相同TCR的Treg)来源的后代Treg细胞被视为一个克隆,因此检测Treg细胞是否发生了克隆扩增,即可知道Treg是否被充分活化发挥免疫抑制功能。
通过单细胞TCR测序分析,研究团队发现敲除了Treg上的IL1R2后,Treg克隆扩增比例显著下降,并且一些免疫抑制基因的表达也明显下调。这代表着敲除IL1R2后,Treg的活化程度降低,免疫抑制功能下降。

敲除Treg上的IL1R2后Treg克隆扩增减少,免疫抑制能力减弱
研究团队也关注了TME中CD8+T细胞的变化,单细胞测序分析结果显示,在接受PD-1抑制剂治疗的小鼠中,cKO小鼠肿瘤中细胞毒CD8+T以及干细胞样CD8+T细胞的比例显著升高,而耗竭的CD8+T细胞明显减少。
这些结果表明,敲除Treg细胞上的IL1R2后,CD8+T细胞的功能显著增强。
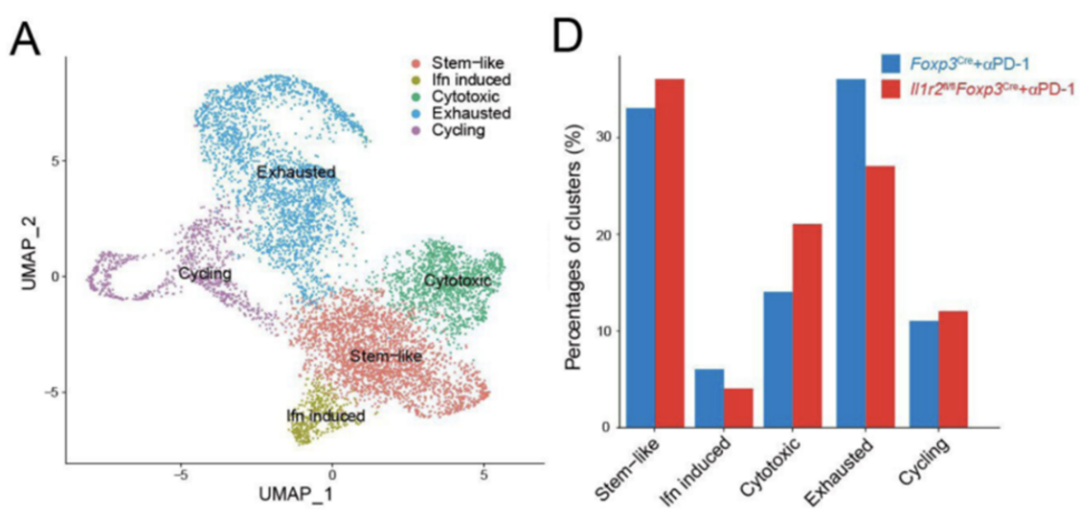
敲除Treg细胞上的IL1R2可以增强CD8+T细胞的功能
总的来说,这项研究成果揭示了Treg上的IL1R2在TME中加强免疫抑制的关键作用,发现Treg上的IL1R2可以通过阻断IL1信号从而增加CAF上MHC-II的表达,进而增强CAF与Treg的相互作用,增加Treg的数量并增强Treg的抑制功能,加速肿瘤生长。
目前的临床数据表明,联合使用PD-1和CTLA-4抑制剂可以取得比单用PD-1抑制剂更好的疗效,这可能是由于联合治疗清除了Treg,但是这也可能会引起严重的副作用。这项研究成果表明,联合阻断IL1R2和PD-1可能是一种有效的抗肿瘤免疫治疗策略,不仅能够增强PD-1抑制剂的疗效,还有助于避免清除整体的Treg引起副作用。
此外,这项研究也有一些遗留问题等待后续研究解答。比如,这项研究发现敲除Treg上的IL1R2后,CAF上MHC-II以及抗原递呈相关基因的表达有显著变化,推测这可能是影响Treg数量的原因,但是并没有进一步的实验验证;此外,CAF递呈的抗原来源以及性质也并不清楚,这也是CAF与肿瘤浸润T细胞相互作用研究中的重要谜题。
参考文献:
1. Costa A, Kieffer Y, Scholer-Dahirel A, et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell 2018;33:e410:463 79.
2.Hwang RF, Moore T, Arumugam T, et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Res 2008;68:918 26.
3. Elyada E, Bolisetty M, Laise P, et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancerassociated fibroblasts. Cancer Discov 2019;9:1102 23.
4. Chen L, Huang H, Zheng X, et al. IL1R2 increases regulatory T cell population in the tumor microenvironment by enhancing MHC-II expression on cancer-associated fibroblasts. Journal for ImmunoTherapy of Cancer 2022;10:e004585. doi:10.1136/jitc-2022-004585
5. De Simone M, Arrigoni A, Rossetti G, et al. Transcriptional landscape of human tissue lymphocytes unveils uniqueness of tumor-infiltrating T regulatory cells. Immunity 2016;45:1135 47
6. Costa A, Kieffer Y, Scholer-Dahirel A, et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell 2018;33:e410:463 79.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 技术突破!中国医学科学院等团队发现结核病诊断新标志物,三个组合准确率高达98.47% (2025-10-08)
- Nat Biomed Eng:用“声波画笔”调控大脑!新型全息超声技术有望打开人类神经疾病治疗新大门 (2025-10-07)
- 《神经元》:短期高脂饮食也同样危险!科学家发现,两天的高脂饮食即可激活小鼠大脑特定抑制性神经元,导致认知受损,恢复正常饮食可逆转 (2025-10-07)
- 相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态 (2025-10-07)
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















