Science:科学家有望利用自我增压的特殊T细胞来杀灭胰腺癌细胞 |
 |
来源:100医药网原创 2022-12-26 10:22
来自加州大学旧金山分校等机构的科学家们通过研究对T细胞进行工程化改造产生了一种强大的抗癌细胞因子,但只有其遇到肿瘤细胞时才会产生,这种免疫疗法能消除小鼠机体中的黑色素瘤和胰腺癌。许多实体瘤都对T细胞疗法没有反应,因为其抑制微环境阻断了T细胞的浸润、激活和增殖;近日,一篇发表在国际杂志Science上题为 Synthetic cytokine circuits that drive T cells into immune-excluded tumors 的研究报告中,来自加州大学旧金山分校等机构的科学家们通过研究对T细胞进行工程化改造产生了一种强大的抗癌细胞因子,但只有其遇到肿瘤细胞时才会产生,这种免疫疗法能消除小鼠机体中的黑色素瘤和,且并不会产生明显的副作用,其或许为抵御上述以及其它难以治疗的癌症提供了一种潜在的新型策略。
这些细胞能产生IL-2,这种强大的炎性分子能通过机体免疫系统自然产生,其能增强T细胞的功能,而T细胞则是一种能杀灭癌细胞并保护机体抵御感染的特殊免疫细胞,尽管几十年来肿瘤学家一直知道IL-2具有潜在的抗癌活性,但由于其在全身给药时所产生的毒性反应,往往让其使用一直会受到限制。这篇研究报告中,研究人员通过对肿瘤浸润的T细胞进行编程来使其在识别癌细胞时会产生自身的IL-2,从而就会使得细胞因子一直被控制在癌症内。研究者Wendell Lim博士说道,我们已经利用了这些细胞作为局部运输制剂的能力,并且金当其识别到其所处的正确位置时才会启动T细胞的扩增器角色,我认为这或许能作为一种特殊模型,而我们能在该模型的帮助下,以一种更有针对性的方式利用细胞疗法运输多种强大但有毒性的疗法制剂。
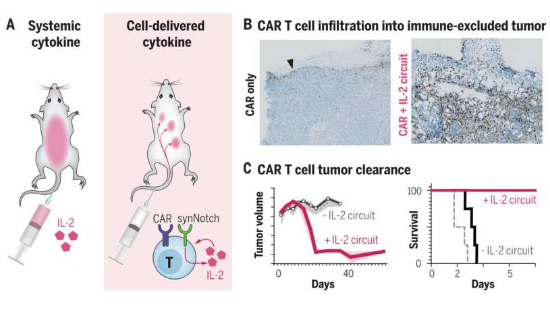
科学家有望利用自我增压的特殊T细胞来杀灭胰腺癌细胞。
图片来源:Science (2022). DOI:10.1126/science.aba1624
细胞疗法对于多种血液癌症的治疗非常有效,因为血液癌症中的癌细胞处于自由漂浮状态,且很容易获得,然而,实体瘤则会构建起多种防御屏障从而预防治疗性的T细胞进入其中,而且如果细胞无法进入到肿瘤中时,其往往在能够毁灭癌细胞之前就会变得疲惫不堪。从20世纪80年代开始,肿瘤学家一直都知道,高剂量的IL-2会促进T细胞克服这些屏障,而且细胞因子也能作为挑战这些癌症病例的新型癌症疗法,但简单地给予病人系统性地输注IL-2或许就会导致高烧、渗漏和器官衰竭。研究者Lim等人旨在通过工程化改造细胞来制服IL-2的效应,从而使得这些细胞只有在其被需要的地方(肿瘤中)来增强抗癌免疫反应。
随后研究人员选择了众所周知难以治疗的肿瘤啊,比如胰腺癌、和等,这些肿瘤几乎会形成铁一般的屏障来抵御T细胞;为了使T细胞能感知其在肿瘤中的位置,研究人员利用一种合成性的Notch(synNotch)受体来进行研究,该受体是一类灵活的分子传感器,早在几年前研究人员开发了这种受体,该受体能横跨细胞膜,其末端在细胞内部和外部都有突出的部分,外面的部分会识别并与肿瘤细胞结合,从而就会诱发里面的部分促进IL-2开始产生。研究人员在一系列致命性的肿瘤中检测了synNotch细胞,包括黑色素瘤和胰腺癌,结果发现,这些细胞能完全按照计划运行。
研究者Allen说道,我们能够设计出这些治疗性的细胞来划过肿瘤的防御屏障,一旦进入肿瘤,其就会建立立足点,并开始有效地杀灭癌变细胞,而我们处于这种肿瘤的顶部,在某些情况下还能治愈它们。这种方法的成功归因于研究人员在细胞中工程化改造了一种回路,其能以一种可控的方式来放大机体的免疫反应,从而就会诱导细胞只有在其被重编程为识别特定的条件下产生IL-2。这种诱导电路实际上是一种正反馈回路,其是制造这些能够如此有效运作的设计T细胞的一个重要因素。当synNotch受体告诉T细胞开始制造IL-2时,该回路就会开始工作,IL-2就会反馈到细胞中并促其分裂,反过来就会产生更多细胞并制造更多的IL-2,整个过程会被限制在肿瘤内,并能保护机体其它部分免受伤害。
研究者表示,最先进的免疫疗法在很多难以治疗的实体瘤中都无法有效发挥作用,我们认为,这种类型的设计或许就能克服主要屏障之一,并以一种安全和无副作用的方式做到这一点。综上,本文研究结果表明,研究人员有望重新配置T细胞回路来重建强大的抗肿瘤反应(CAR/TCR激活和炎性细胞因子信号)所需的关键输出,但其方式是绕过抑制的关键点;因此,这类工程化局部细胞因子运输回路或许就能提供一种潜在的通用性策略来驱动抵御免疫抑制的实体瘤的有效T细胞活性。(100yiyao.com)
原始出处:
GREG M. ALLEN,NICHOLAS W. FRANKEL,NISHITH R. REDDY, et al. , Science (2022). DOI:10.1126/science.aba1624
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nat Biomed Eng:用“声波画笔”调控大脑!新型全息超声技术有望打开人类神经疾病治疗新大门 (2025-10-07)
- 《神经元》:短期高脂饮食也同样危险!科学家发现,两天的高脂饮食即可激活小鼠大脑特定抑制性神经元,导致认知受损,恢复正常饮食可逆转 (2025-10-07)
- 相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态 (2025-10-07)
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















