中科院化学所汪铭团队开发细胞选择性CRISPR |
 |
来源:生物世界 2023-01-03 11:17
CRISPR-Cas9是基于细菌/古菌的获得性免疫系统而开发的新一代基因编辑技术,在化学生物学、生物医学及基因治疗中具有潜在应用前景。CRISPR-Cas9是基于细菌/古菌的获得性系统而开发的新一代基因编辑技术,在化学生物学、生物医学及基因治疗中具有潜在应用前景。CRISPR-Cas9技术使用向导RNA(sgRNA)识别靶标基因,并招募Cas9核酸酶对基因组进行切割、编辑等操作。
然而,由于sgRNA识别基因组存在非特异性结合作用,现有CRISPR-Cas9技术应用于基因编辑时存在一定的脱靶效应,且缺乏对疾病细胞的选择性,限制了其在化学生物学领域的应用。
中国科学院化学研究所研究员汪铭课题组在JACS上发表了题为:Orthogonal Chemical Activation of Enzyme-Inducible CRISPR/Cas9 for Cell-Selective Genome Editing的研究论文。
该研究开发了一种正交化学激活的酶诱导的CRISPR系统(eiCRISPR),实现了细胞选择性基因编辑。该方法为解决CRISPR-Cas9技术中面临的基因编辑脱靶效应以及缺乏疾病靶向性等挑战提供了新策略。

汪铭课题组围绕可控及细胞选择性CRISPR-Cas9技术开展研究,发展了酶诱导的CRISPR系统(enzyme-inducible CRISPR,eiCRISPR),实现了细胞选择性基因编辑。
eiCRISPR由三部分组成,包括Cas9核酸酶、自封闭失活的向导RNA(bsgRNA)以及化学修饰的脱氧核酶DNAzyme,其中DNAzyme可特异性降解bsgRNA的自封闭区进而激活CRISPR系统。
为了实现可控及细胞选择性基因编辑,他们通过设计优化DNAzyme磷酸骨架的化学修饰,抑制了其降解bsgRNA自封闭区的能力;而外源性光信号、内源性化学微环境(如细胞内活性氧、NQO1酶)等可选择性触发化学修饰DNAzyme的脱笼反应,激活DNAzyme并降解bsgRNA的自封闭区,进而激活eiCRISPR系统。
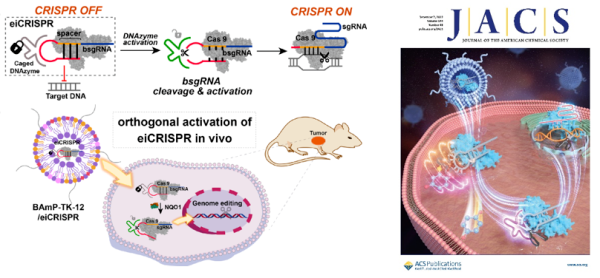
酶促反应激活的细胞选择性CRISPR-Cas9基因编辑系统
研究团队进一步利用其发展的可降解脂质纳米颗粒(LNP)递送系统,实现了细胞及活体层次eiCRISPR的高效递送和在体激活。研究发现,eiCRISPR可在肿瘤组织中被选择性激活,并编辑、敲低人乳头瘤病毒18(HPV18)E6基因,从而可用于潜在的肿瘤治疗。
该方法为解决CRISPR-Cas9技术中面临的基因编辑脱靶效应以及缺乏疾病靶向性等挑战提供了新策略。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nat Biomed Eng:用“声波画笔”调控大脑!新型全息超声技术有望打开人类神经疾病治疗新大门 (2025-10-07)
- 《神经元》:短期高脂饮食也同样危险!科学家发现,两天的高脂饮食即可激活小鼠大脑特定抑制性神经元,导致认知受损,恢复正常饮食可逆转 (2025-10-07)
- 相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态 (2025-10-07)
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















