Nature子刊:破坏相分离,增强抗肿瘤免疫 |
 |
来源:生物世界 2023-03-15 17:21
该研究揭示了在IFNγ刺激下,肿瘤细胞中KAT8-IRF1通过形成具有促进转录功能的凝聚体,增强PD-L1表达的分子机制;发现了凝聚体形成可增强KAT8对IRF1乙酰化催化速率;开发了抑制凝聚体形成的肿瘤细胞表达的PD-L1是抗肿瘤监视的主要抑制因子之一,肿瘤微环境中伽马干扰素IFN 可强烈诱导PD-L1表达。PD-L1通过与PD-1结合,抑制T细胞增殖并促进其耗竭;在肿瘤细胞内部,PD-L1发挥多种功能促进逃逸,如增加肿瘤细胞抵抗干扰素的细胞毒性、增强DNA损伤修复和促进免疫抑制基因的表达。临床上,靶向肿瘤PD-L1的免疫治疗在部分肿瘤取得了良好的治疗效果,但仍面临机制不明、响应率低等诸多问题。因此,系统性深入研究PD-L1表达调控机制,有助于开发新的靶向药物,对于肿瘤治疗有重要意义。
生物大分子可通过多价弱相互作用介导的液-液相分离(LLPS,简称相分离)形成生物分子凝聚体(biomolecular condensates),该理论是近年生命科学领域的概念性突破。相分离与神经退行性疾病、肿瘤、病毒感染等重大疾病密切相关,靶向相分离过程的疾病治疗是目前生物医学前沿。但目前相分离过程的靶点鉴定、发生机制、与疾病发生发展的关系等研究仍处于起步阶段,亟待深入探索。
近日,中山大学肿瘤防治中心康铁邦/武远众团队在Nature子刊Nature Cancer上发表了题为:Disrupting the phase separation of KAT8 IRF1 diminishes PD-L1 expression and promotes antitumor immunity的研究成果。
该研究揭示了KAT8-IRF1凝聚体促进肿瘤细胞PD-L1表达,开发特异性多肽阻断该凝聚体形成,可增强抗肿瘤免疫。

为深入揭示IFN 诱导PD-L1表达的调控机制,研究团队利用全基因组CRISPR-Cas9文库进行筛选,发现乙酰转移酶KAT8可调控PD-L1的表达,这一机制在多种肿瘤细胞系中得到验证。KAT8是细胞内组蛋白H4K16ac主要乙酰转移酶,除此之外,KAT8也被报道乙酰化非组蛋白底物,调控细胞自噬、压力应激等过程。接下来,研究团队试图探明KAT8通过何种机制调控PD-L1转录。利用TurboID邻近标记联合质谱分析,研究团队鉴定到转录因子IRF1与KAT8存在相互作用,IRF1是IFN 通路下游分子之一,已被报道可转录上调PD-L1。
接下来,研究团队探究了KAT8与IRF1如何调控PD-L1。在检测二者定位时,发现共表达mEGFP-KAT8与IRF1-mCherry在细胞核内可形成液滴状凝聚体,该凝聚体具有融合及荧光漂白恢复能力,体外纯化的蛋白也具有相同性质,提示KAT8-IRF1通过液-液相分离形成蛋白凝聚体。进一步,研究团队测定了IFN 刺激下细胞核内源KAT8与IRF1的蛋白浓度,并在体外实验中观察到生理浓度下的凝聚体形成,同时,研究团队利用SIM超分辨成像,观察到细胞核内存在KAT8-IRF1共定位斑点,提示KAT8-IRF1在生理浓度水平可形成蛋白凝聚体。
然后,研究团队解析了KAT8-IRF1凝聚体产生的结构基础。首先,IRF1 N端DNA结合结构域与KAT8发生特异性互作,然后发生IRF1 C端的内在无序结构域(Intrinsically disordered region, IDR)与KAT8 N端IDR互作,共同介导凝聚体形成。KAT8-IRF1凝聚体可募集RNAP II-S5P、CDK7、CDK9、BRD4等转录机器组分,并增强转录激活能力。利用dCas9-SunTag-sgARRAY进行基因组定位,研究团队观察到内源KAT8-IRF1凝聚体可定位于PD-L1启动子。
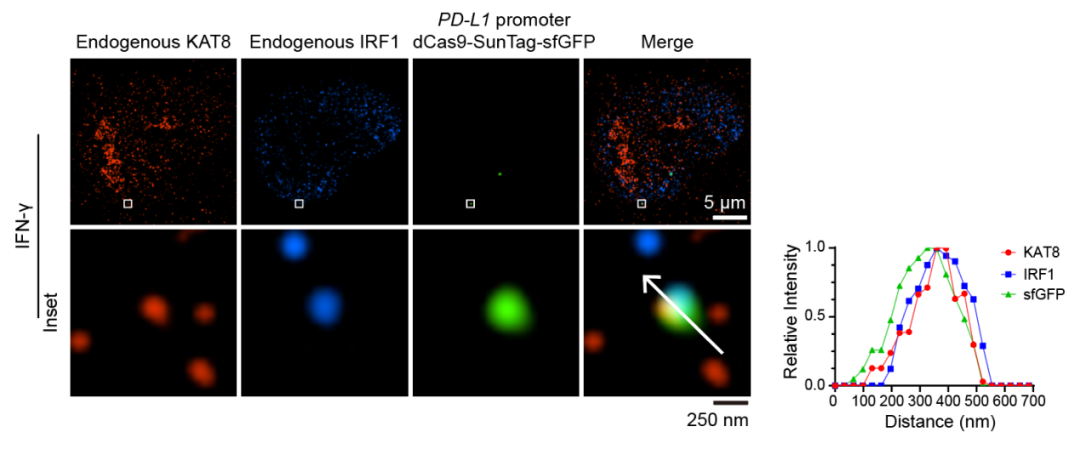
图1. 内源KAT8与IRF1在PD-L1启动子区域形成凝聚体
KAT8已报道可催化非组蛋白底物,研究团队发现KAT8可乙酰化IRF1 K78位点,凝聚体形成可增强催化速率约40倍,IRF1 K78ac可增强与PD-L1启动子结合能力。
根据KAT8-IRF1凝聚体形成的结构基础,研究团队基于IRF1 N端与KAT8的特异性相互作用进行深入分析,发现IRF1的21-42位氨基酸是介导特异性互作的主要区域。进而研究人员合成了该区域的竞争性多肽,并观察到该多肽可特异性阻断二者相互作用并破坏凝聚体形成,抑制IRF1乙酰化及PD-L1转录,增强T细胞的抗肿瘤免疫杀伤。

图2:KAT8-IRF1 相分离促进肿瘤细胞 PD-L1表达,阻断该相分离抑制PD-L1, 促进抗肿瘤免疫
综上,该研究揭示了在IFN 刺激下,肿瘤细胞中KAT8-IRF1通过形成具有促进转录功能的凝聚体,增强PD-L1表达的分子机制;发现了凝聚体形成可增强KAT8对IRF1乙酰化催化速率;开发了抑制凝聚体形成的阻断多肽,并证明其抗肿瘤活性。该研究提示肿瘤相关生物大分子凝聚体可能是一类肿瘤治疗新靶点,值得深入探索。
中山大学肿瘤防治中心武远众副研究员、周立文博士为该论文共同第一作者;中山大学肿瘤防治中心康铁邦教授为通讯作者。
康铁邦教授以通讯作者在 Nat Cancer、Nat Cell Biol、Cell Res、J Clin Invest、Nat Commun 等国际主流杂志上发表论著50多篇。武远众副研究员为课题组co-PI,以通讯/第一作者发表 Nat Cancer、Nucleic Acids Res、Cell Res、Cell Discov、Nat Commun、JBC、Cell Mol Life Sci、STTT 等杂志。该课题组长期招聘博士后,欢迎有志者加盟。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nat Biomed Eng:用“声波画笔”调控大脑!新型全息超声技术有望打开人类神经疾病治疗新大门 (2025-10-07)
- 《神经元》:短期高脂饮食也同样危险!科学家发现,两天的高脂饮食即可激活小鼠大脑特定抑制性神经元,导致认知受损,恢复正常饮食可逆转 (2025-10-07)
- 相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态 (2025-10-07)
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















