Adv. Sci:针对SRC |
 |
来源:100医药网 2024-07-28 13:17
该研究揭示了SRC-1在调节PD-L1表达中的重要作用,针对SRC-1联合PD-L1抗体免疫治疗可能是CRC治疗的一种有吸引力的策略。(CRC)是一种常见的胃肠道肿瘤,是全球癌症死亡的主要原因。传统的癌症治疗方法副作用多,转移和复发风险高,对局部或全身转移患者的疗效有限。近几十年来,肿瘤疗法的出现使癌症治疗发生了革命性的变化,其目的是通过刺激或重建免疫系统来消除恶性细胞,但表达的免疫抑制分子使其能够逃避免疫系统的监视,这限制了免疫治疗的效果。
程序性死亡配体1 (PD-L1)(也称为CD274)和程序性死亡-1 (PD-1)依赖途径是重要的免疫检查点,引起了广泛的关注。实体瘤细胞上表达的PD-L1与肿瘤浸润淋巴细胞(til)上的PD-1相互作用,损害免疫细胞的功能和激活,引发逃逸。PD-L1过表达与肿瘤的免疫逃逸和不良预后有关。因此,明确PD-L1表达和功能调控的不同机制可能为靶向PD-L1提高肿瘤免疫治疗的临床疗效提供分子基础。
基因组改变、异常的致癌信号、外源因素和表观遗传机制与PD-L1在肿瘤内表达的诱导密切相关。Myc和Wnt/ -catenin通路的激活上调了多种肿瘤中PD-L1的表达。PTEN是一种众所周知的肿瘤抑制基因,基因缺失可通过PI3K/AKT和 -catenin/c-Myc信号通路上调PDL1的转录。

图片来源:
近日,来自厦门大学的研究者们在Adv. Sci.杂志上发表了题为 Targeting Nuclear Receptor Coactivator SRC-1 Prevents Colorectal Cancer Immune Escape by Reducing Transcription and Protein Stability of PD-L1 的文章,该研究揭示了SRC-1在调节PD-L1表达中的重要作用,针对SRC-1联合PD-L1抗体免疫治疗可能是CRC治疗的一种有吸引力的策略。
程序性死亡配体1 (PD-L1)在多种癌症中过度表达,对其免疫逃逸至关重要。先前的研究表明,核共激活子SRC-1通过增强CRC细胞活力促进结直肠癌(CRC)的进展,但其在CRC免疫逃逸中的作用尚不清楚。
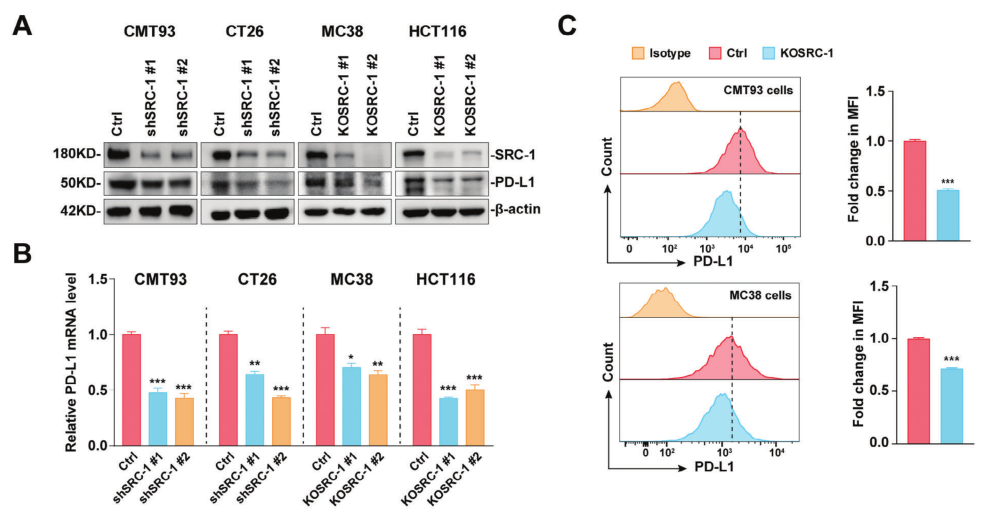
SRC-1上调PD-L1表达,促进结直肠癌免疫逃逸
图片来源:
在本研究中,研究者证明了SRC-1在人类CRC标本中与PD-L1呈正相关。SRC-1缺乏通过增加CD8+ T细胞的肿瘤浸润增强CRC免疫逃逸,显著抑制CRC细胞中PD-L1的表达,延缓小鼠CRC在皮下移植物中的生长。小鼠SRC-1基因消融也会降低AOM/ dss诱导的小鼠CRC中PD-L1的表达。这些结果表明,肿瘤源性SRC-1通过增强PD-L1表达促进结直肠癌免疫逃逸。
机制上,SRC-1通过抑制SOCS1表达激活JAK-STAT信号,协同激活STAT3和IRF1,增强PD-L1转录,并通过抑制斑点型POZ蛋白(SPOP)介导的蛋白酶体依赖性降解来稳定PD-L1蛋白。SRC-1的药理抑制提高了PD-L1抗体在皮下移植和AOM/ dss诱导的小鼠CRC模型中的抗肿瘤作用。
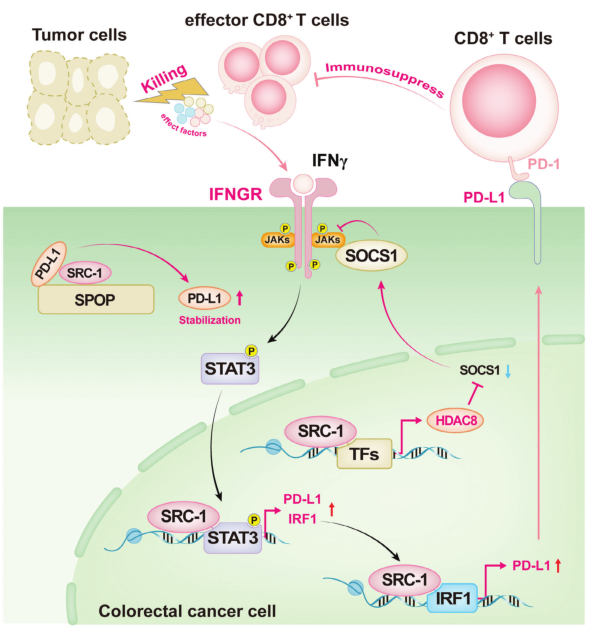
SRC-1通过提高PD-L1转录和蛋白稳定促进结直肠癌免疫逃逸机制的示意图
图片来源:
综上所述,本研究表明,SRC-1通过激活JAK1-STAT3信号,上调PD-L1的表达,并通过阻止PD-L1与SPOP相互作用,提高PD-L1蛋白的稳定性,从而促进结直肠癌的免疫逃逸。此外,本研究表明,SRC-1抑制剂和PD-L1抗体联合治疗远优于单用任何一种治疗,代表了一种新的策略来增强高水平SRC-1 CRC患者的免疫治疗。( 100yiyao.com)
参考文献:
Yilin Hong et al. Targeting Nuclear Receptor Coactivator SRC-1 Prevents Colorectal Cancer Immune Escape by Reducing Transcription and Protein Stability of PD-L1. Adv Sci (Weinh). 2024 Jul 2:e2310037. doi: 10.1002/advs.202310037.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 两篇《自然》:肺癌私联神经元!科学家首次发现小细胞肺癌细胞会在脑内与神经元形成突触,借助电信号促进肿瘤生长 (2025-09-16)
- Sci Adv:新型双特异性抗体有望成为抗击巨细胞病毒的“免疫特种兵” (2025-09-16)
- 《神经病学》:代糖或伤认知!8年随访发现,摄入较多代糖与记忆力、语言流畅性和整体认知能力下降速度提升32%、173%和62%相关 (2025-09-16)
- Nature子刊:超越ADC,中国博后发明ABC药物,重拳出击,精准靶向 (2025-09-16)
- Cell子刊:“滴血验癌”新突破,王延博/张硕等利用细胞外囊泡,精准检测10多种癌症 (2025-09-16)
- 47亿!派林生物易主中国生物,血液制品行业格局将重塑 (2025-09-15)
- 【9月16日直播预告】从样本到洞察:蛋白质组学智能实验室的自动化流程与AI高效赋能 (2025-09-15)
- 聚焦靶向蛋白降解、小核酸、多肽、细胞治疗等热点议题,与60+行业领袖共探生物医药未来。10月16-17日,深圳,期待您的加入! (2025-09-15)
- Nature子刊:个性化定制碱基编辑器,治疗致命血管疾病 (2025-09-15)
- 智力出现障碍的罪魁祸首!Cell Rep:两种“染色质管家”联手失控,神经元“身份混乱”致认知受损 (2025-09-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















