武田Entyvio医治UC的III期临床进一步成果出炉 |
 |
9月26日,武田制药宣告评价肠道选择性新型抗炎药Entyvio(vedolizumab)医治溃疡性结肠炎(UC)的III期临床VARSITY(NCT02497469)的进一步成果已揭橥于《新英格兰医学杂志》。该研讨是UC范畴首个头仇人生物制剂研讨,成果显示,在医治中度至重度运动性UC患者时,与修美乐(Humira)比拟,Entyvio在次要起点(第52周临床缓解率)和主要起点(第52周内镜下黏膜愈合率)表示出了优效。
VARSITY是一项随机、双盲、双模仿、多中间、阳性药物对比、IIIb期研讨,旨在评价Entyvio静脉打针(IV)与Humira皮下打针(SC)用于中度至重度运动性UC患者医治一年(52周)的疗效和平安性。该研讨共医治了769例患者(Entyvio医治组n=383例;Humira医治组n=386),一切患者在入组前对皮质类固醇、免疫调理剂或除Humira以外的一种坏逝世因子α(TNFα)拮抗剂反响缺乏、掉去反响或不耐受。研讨中,25%的患者先前承受过TNFα拮抗剂医治,609例为抗TNFα初治患者,160例为抗TNFα经治患者。
研讨中,患者被随机分为两组:Entyvio IV+抚慰剂SC,抚慰剂IV+Humira SC。Entyvio医治组患者在第0、2、6周、之后每8周一次直至第46周承受Entyvio IV 300mg,在第0周、之后每2周一次直至第50周承受抚慰剂SC。Humira医治组在第0周承受Humira SC 160mg、第2周80mg、之后每2周一次40mg直至第50周,同时在第0、2、6周、之后每8周一次直至第46周承受抚慰剂IV。研讨时代,两个组均不许可剂量添加。次要起点是临床缓解,界说为完好Mayo评分≤2分且无单项>1分。主要起点包含黏膜愈合(界说为Mayo内窥镜单项≤1分)和无糖皮质激素临床缓解(界说为在基线[第0周]时应用口服糖皮质激素的患者已停滞口服糖皮质激素,并在第52周完成临床缓解)。
成果显示,研讨到达了次要起点,与Humira组比拟,Entyvio组在第52周临床缓解率方面表示出优胜性(31.3% vs 22.5%,p=0.006)。摸索性剖析显示,在第52周,与Humira比拟,Entyvio在抗TNFα初治患者亚组(34.2% vs 24.3%)和抗TNFα经治患者亚组(20.3% vs 16.0%)获得了更高的临床缓解率。此外,Entyvio组有26.6%的患者在第14周到达临床缓解,Humira组为21.2%。Entyvio组有18.3%的患者完成耐久临床缓解,Humira组为11.9%。
第52周内镜下黏膜愈合率方面,与Humira组比拟,Entyvio组明显进步(39.7% vs 27.7%;p<0.001)。
摸索性剖析显示,在第52周,与Humira比拟,Entyvio在抗TNFα初治患者亚组(43.1 vs 29.5%)和抗TNFα经治患者亚组(26.6% vs 21.0%)均获得了更高的内镜下黏膜愈合率。
无皮质类固醇临床缓解方面,在基线时应用口服皮质类固醇的患者中,停用皮质类固醇并在第52周获得临床缓解的患者比例Entyvio组低于Humira组(12.6% vs 21.8%),在抗TNFα初治患者亚组(14.9% vs 21.7%)和抗TNFα经治患者亚组(4.2% vs 22.2%)中也低于Humira组。
口服皮质类固醇中位变更的摸索性成果显示,从基线至第52周,Entyvio组皮质类固醇应用量中位变更为-10.0mg,Humira组为-7.0mg。
剖析成果还标明,Entyvio医治与生涯质量改良相干,Entyvio组有52.0%、Humira组有42.2%在炎症性肠病问卷评分从基线至第52周改良≥16分。问卷反省了炎症性肠病对患者生涯四个方面的影响:与原发性肠道疾病直接相干的症状、全身症状、情感和社会功效。
此外,还展开了一项摸索性剖析,评价Entyvio与Humira对临床反响和无运动性组织学疾病的影响。成果显示,Entyvio组有67.1%在第14周到达临床反响,而Humira组为45.9%,临床反响早在第6周就呈现了别离,数据有利于Entyvio。无运动性组织学疾病由GEBOES评分(<3.2)和Robarts病理组织学指数(<5)界说,在第52周,Entyvio组患者达标比例为33.4%和42.3%,Humira组辨别为13.7%和25.6%。
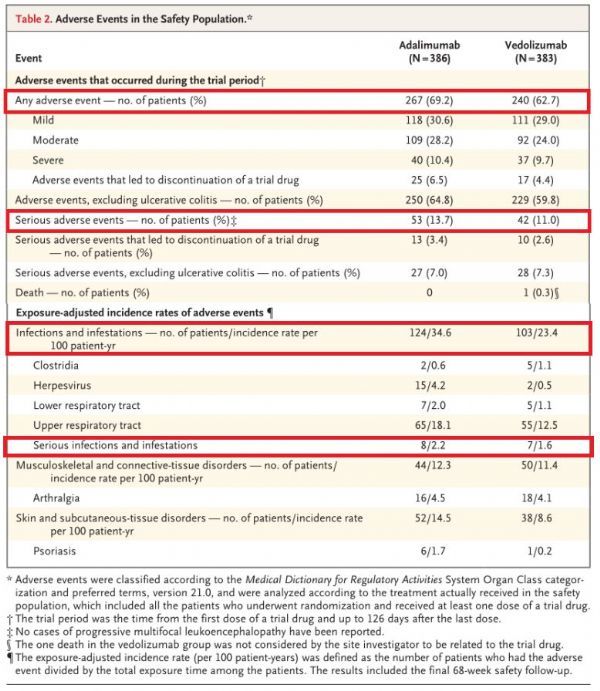
虽然研讨并非专门比拟两种生物制剂的平安性,但与Humira比拟,Entyvio在平安性方面表示更好,详细数据为:在医治时代,Entyvio组患者的总体不良事情产生率(62.7% vs 69.2%)、严重不良事情产生率(11.0% vs 13.7%)、沾染产生率(23.4% vs 34.6%)、严重沾染产生率(1.6% vs 2.2%)均较低。
在临床上,医治UC等慢性致衰性肠道疾病时,使患者在疾病多个方面取得缓解十分主要。VARSITY研讨成果为大夫供给了名贵的见地,以支撑其在UC患者中启动生物医治时的医治决议计划。
该研讨初次在医治UC方面临两种生物制剂停止了比拟,显示了Entyvio与Humira比拟在疗效和改良总体生涯质量方面的好处。这些数据进一步支撑了Entyvio作为一线生物疗法在UC医治方面的使用。
Entyvio是一种肠道选择性生物制剂,其活性药物成分为vedolizumab,这是一种人源化单克隆抗体,可特异性拮抗α4β7整合素,克制α4β7整合素对肠道黏膜细胞粘附分子MAdCAM-1的联合。
Entyvio于2014年5月获美国和欧盟同意上市。今朝,IV剂型Entyvio已获全球60多个国度/地域同意,用于中度至重度运动性UC或克罗恩病(CD)成人患者的医治。(100yiyao.com)
医药网新闻
- 相关报道
-
- 国内“三甲”医院纷纷布局细胞治疗,脐带血免疫细胞治疗迎来新机遇 (2025-07-07)
- 告别乙肝,全球首个针对慢性乙肝的细胞治疗产品SCG101V获批临床 (2025-07-07)
- 注射用氢化可的松琥珀酸钠通过仿制药质量和疗效一致性评价 (2025-07-07)
- 内蒙古安迪科同位素诊疗药物生产中心举行奠基仪式 (2025-07-07)
- 中国工程院党组成员、副院长王辰院士一行莅临东诚药业调研交流 (2025-07-07)
- EIZO艺卓正式推出数字病理专业系列显示器 (2025-07-07)
- 腾盛博药宣布与健康元集团就BRII-693的大中华区权益达成许可协议 (2025-07-07)
- 康缘药业×胜普泽泰战略合作结硕果:AI赋能研发提速,KYS2301凝胶IND申报成功 (2025-07-07)
- 中国首个:金赛药业伏欣奇拜单抗获批,半年降低痛风复发风险87% (2025-07-07)
- 干细胞培育的免疫尖兵组队出击!Bioact Mater:荧光叶酸当向导,中性粒细胞与NK细胞协同发力,精准突破实体瘤防线 (2025-07-07)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















