国内近80个双抗体涌入超500亿!方与恒瑞. |
 |
步入2022年,双抗研发领域;d迎来了一个又一个好消息。1月5日,康方生物宣布,其自主研发的氯胺酮单克隆抗体(AK104)联合AK112单克隆抗体的Ib/II期临床试验申请获得NMPA批准,用于治疗晚期非小细胞肺癌,无论是否进行化疗。这项临床研究是世界上第一次单克隆抗体和单克隆抗体的联合治疗。1月6日,傅宏翰林PD-L1/TIGIT双抗体HLX301治疗各种晚期实体瘤临床试验申请获NMPA受理,这是国内临床申报的第三个PD-L1/TIGIT双抗体。近年来,我国新型大分子药物的研发迅速升温,双特异性抗体迎来研发热潮。目前国内约有80种单克隆抗体处于临床阶段,以PD-(L)1为靶点的单克隆抗体最为火热。凯宁单抗进展最快,已处于申请上市阶段。预计今年将拿下国内首个单克隆抗体,销售高峰为50亿元。
全球仅4款上市,双抗领域前景广阔
双药主要是指含有两个特异性抗原结合位点的人工抗体,可以同时与靶细胞和T细胞相互作用,介导一系列免疫反应。与传统单克隆抗体相比,单克隆抗体具有靶向性更精确、治疗效果更强的优点。理论上,McAb可以起到“1 12”的作用。正是由于其巨大的治疗潜力,双抗体药物前景广阔,逐渐成为新药研发和投资的“新宠”。
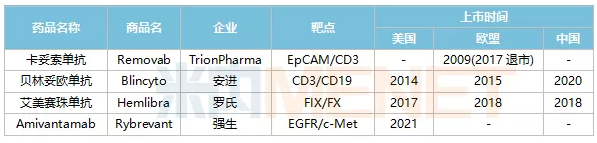
2021年5月21日,——强生公司的Amivantamab强生是世界上第四种双抗体药物,被美国食品和药物管理局批准用于治疗EGFR突变的非小细胞肺癌。世界上第一种双抗体药物上市已经10多年了。在过去的10年里,除了强生公司的Amivantamab之外,世界上只有四种单克隆抗体上市。Johnson,TrionPharma的katosomab,Amgen的Belindao单克隆抗体,罗氏的aimeizumab。其中,艾美珠单抗和贝林单抗分别于2018年和2020年获批在中国上市,这也是目前国内仅有的两种已上市的双抗体药物。
表1:全球上市的双抗体药物
国内80款在临床阶段,信达、百济神州、恒瑞等均有布局
聚焦国内双抗体领域,双抗体研发热潮持续。据统计,目前有近80种双抗体药物正在研发中;d状态的申报诊所及以上,国内44家以上药企参与布局。
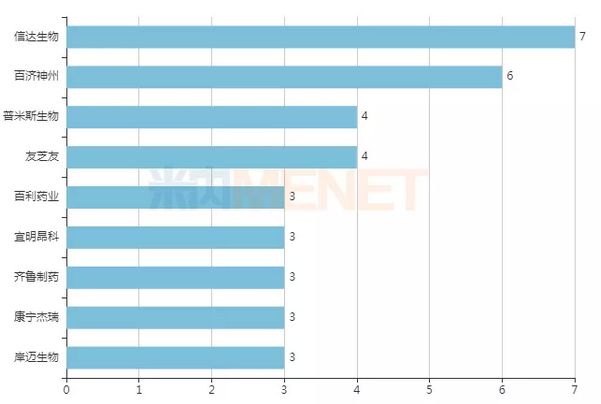
数量上,信达生物是双抗体领域的“大家族”,临床阶段双抗体药物有7种,是国内双抗体药物数量最多的制药公司。百济神州临床阶段有6种双抗体,其中1种是与Zymeworks合作获得的,其余5种是与安进合作引进的。此外,临床阶段双抗体品种超过3个的国内药企还有普米思生物(4家)、优智优(4家)、百力药业(3家)、益铭昂科(3家)、齐鲁制药(3家)、康宁杰瑞(3家)、安迈生物(3家)。
图1, :国内临床阶段双抗体3种以上的药企
从研发进展来看,康方生物的克丹宁单克隆抗体(AK104)进展最快。2021年9月,CDE批准PD-1/CTLA4双抗体克丹宁单克隆抗体(AK104)上市治疗复发或转移性宫颈癌,并给予其优先评价资格。恒瑞的PD-L1/TGFB双抗体SHR-1701、康宁杰瑞的PD-L1/CTLA4双抗体重组人源化PDL1/CTLA-4双特异性单结构域抗体Fc融合蛋白(KN046)、康方Bio AK112的另一双抗体、百济神州抗HER2多位点双抗体ZW25、广东凌腾引进的EpCAM/CD3双抗体卡多索。
表2:国内双抗体研究现状
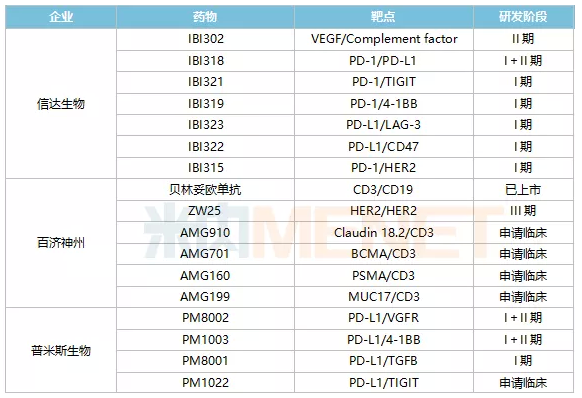
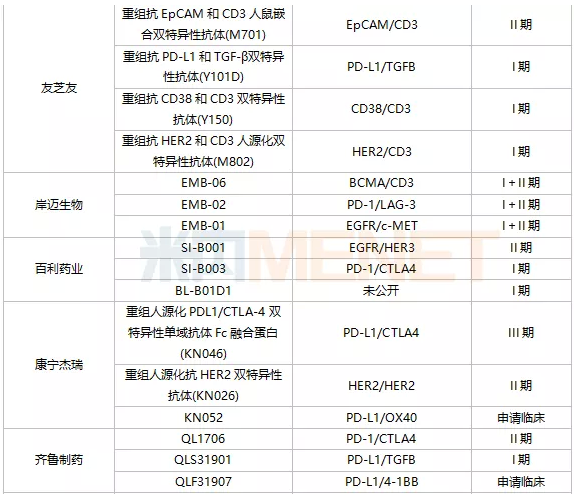
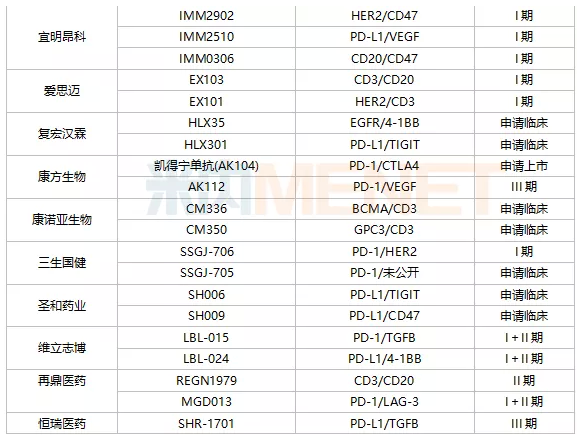
注:仅计算临床及以上应用阶段;统计日期截至2022年1月初。
从靶点的研发热情来看,PD-L1/TGFB是国内双抗体研发中最受欢迎的组合。按块
目前国内有8种PD-L1/TGFB抗体处于临床阶段,其中恒瑞的SHR-1701处于临床期。据中国药品临床试验宣传数据库显示,目前已启动15项相关临床研究,非小细胞肺癌、胃癌、宫颈癌等适应症处于临床期。截至目前,恒瑞已投入研发资金约2.22亿元;相关项目。值得一提的是,这一目标组合尚未上市。默克M7824曾是全球增长最快的双抗体,2021年接连四次临床试验失败。这可能是恒瑞弯道超车的机会。如果能及时调整策略,SHR-1701可能会成为“一流”。
根据单靶点研发热度统计,PD-(L)1是双抗体领域当之无愧的靶点,“社会人才”。纳入统计的78个双抗体药物中,基于PD-1靶点的有16个,基于PD-L1靶点的有32个,共有47个双抗体靶点涉及PD-(L)1靶点,占临床阶段双抗体药物总数的一半以上,这与PD-(L)1研发热潮下医药公司寻求差异化的策略有关。
多方位布局,50亿双抗上市在即
凯宁单克隆抗体(AK104)是康方生物自主研发的具有PD-1/CTLA4双重特异性的新型肿瘤免疫治疗药物。它可以同时靶向两种已验证的免疫检查点分子:程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞相关蛋白4(CTLA4)。因此,已经显示了PD-1和CTLA4单克隆抗体与PD-1联合治疗的临床疗效。
根据全球新药研发的数据;研发中心Minenet的数据库;d图的克登单抗不局限于国内市场,还在美国、澳大利亚和新西兰进行了多项临床试验。正在研究的适应症涉及多种肿瘤,包括宫颈癌、胃癌、食管癌、肾细胞癌、非小细胞肺癌、腺癌、淋巴瘤、实体瘤、乳腺癌、鳞状细胞癌、黑色素瘤、肝细胞癌、鼻咽癌等。在国内,已有超过13项临床试验使用克登单抗,其中2020年中国癌症免疫大会上披露的克登单抗治疗复发或转移性宫颈癌的临床试验结果显示,客观缓解率(ORR)达到47.6%,与PD-1单药治疗或CTLA4联合治疗相比,疗效显著提高。
基于其在临床试验中的优异表现,2021年9月26日,CDE已同意康方生物提交治疗复发或转移性宫颈癌的新药上市申请,并给予优先审评资格。宁珂单克隆抗体有望在2022年获批,并获得“一流”等一系列重磅称号,全球首个PD-1/CTLA4双抗体和国内首个双抗体。根据券商预测,凯德宁单抗销售高峰有望达到50亿元。
图3:凯德宁单克隆抗体的具体布局

来源:全球新药研发图书馆
结语
预测显示,随着全新双抗体进入市场,上市双抗体获批的适应症更多,2025年全球双抗体市场规模将超过500亿元。近年来,我国创新药物研发迎来新高潮。在康方生物、康宁杰瑞、恒瑞医药等企业的指导下,双抗药物研发在千帆呈现出一派热闹的竞争景象。国内首个双抗体药物即将上市,但伴随而来的商业化风险也不容小觑。如何调整策略,规避风险,是康方生物的课题。但双抗赛道上的后手更要注意减少同质化竞争,寻求产品差异化,才有机会赶超前者。
来源:公共信息,内联网数据库,公司公告。
如有遗漏,请指正!
医药网新闻
- 相关报道
-
- Nature Methods:细胞的“秘密自拍”!一部揭示近两万个基因功能的视觉百科全书 (2025-08-12)
- 广西规范整合产科及麻醉类医疗服务名目价钱的关照 (2025-08-12)
- 反超OpenAI,百川开源大模型医疗能力登顶世界第一 (2025-08-12)
- 《自然》:科学家首次发现,EB病毒让B细胞和T细胞涌入大脑,引发多发性硬化症! (2025-08-12)
- Nature子刊:哈佛大学研究发现,猪油/牛油等动物油会抑制免疫系统,促进癌症发展 (2025-08-12)
- 复旦大学基因治疗耳聋临床研究登上Cell子刊封面 (2025-08-12)
- Science:使用AI模型预测哪些启动子突变会改变基因表达 (2025-08-12)
- AMI Pharm推动AYP-101进入三期临床,开启减脂注射药新纪元 (2025-08-11)
- 关于举办“人工智能赋能药物研发全流程技术应用’高级研修班的通知 (2025-08-11)
- 己糖激酶2通过蛋白激酶活性促进外泌体生成参与急性缺血性脑卒中损伤 (2025-08-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















