全球首款现货型T细胞疗法获CHMP支持,有望年底上市 |
 |
来源:医药魔方 2022-10-17 15:34
如果获得批准,Ebvallo将成为全球首款获批的同种异体T细胞疗法。Atara和Pierre Fabre宣布,欧洲药品局(EMA)人用药品委员会(CHMP)对其现货型T细胞疗法Ebvallo(tabelecleucel)的上市申请给予积极意见,建议欧洲委员会(EC)批准该产品单药用于治疗两岁以上儿童和成人复发或难治性Epstein-Barr病毒阳性移植后淋巴增生性疾病(EBV+ PTLD),这些患者既往至少接受过一次治疗。如果获得批准,Ebvallo将成为全球首款获批的同种异体T细胞疗法。

EBV+PTLD是一种罕见、急性且可能致命的血液系统恶性肿瘤。当移植后患者的T细胞活性因抑制而受损时,可引发此类疾病。接受实体器官移植(SOT)或同种异体HCT的患者均会受此疾病影响。HCT和SOT后经利妥昔单抗 化疗失败的EBV+PTLD患者的中位生存期仅为0.7个月和4.1个月。患者对有效、安全和快速起效的新型治疗方案具有迫切需求。
Ebvallo是一种异基因EBV特异性T细胞免疫疗法,它以HLA限制的方式靶向并消除EBV感染细胞。Ebvallo已被美国授予治疗利妥昔单抗难治性EBV相关淋巴增生性疾病(LPD)的突破性疗法资格和孤儿药称号。
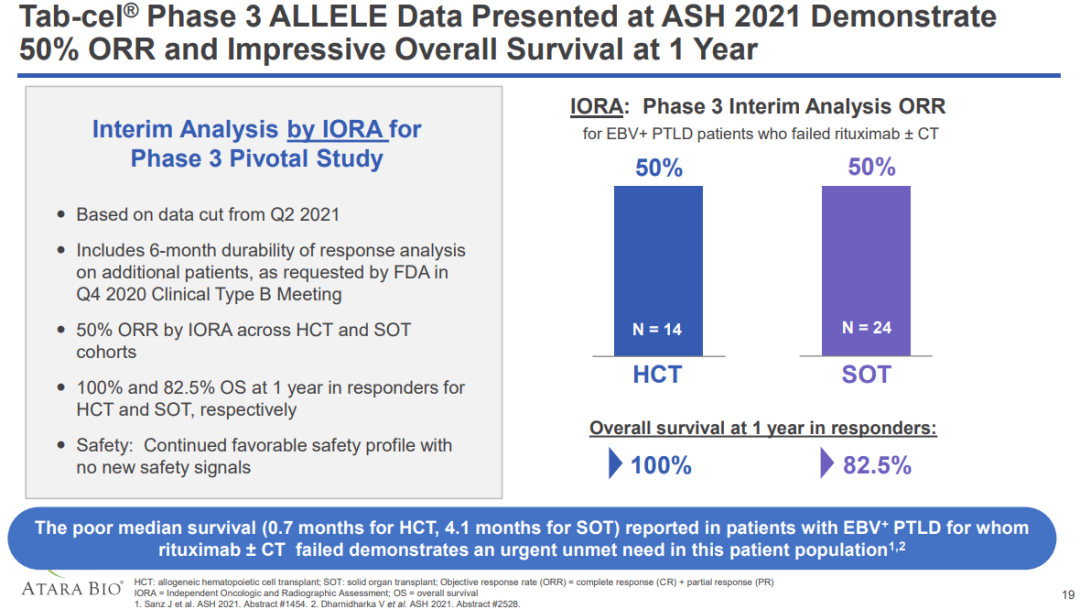
CHMP的积极意见是基于关键III期ALLELE研究结果。在这项研究中,Ebvallo显示出了良好的风险-收益比。截至2021年5月,24例利妥昔单抗+化疗治疗失败的SOT后EBV+PTLD患者和14例利妥昔单抗单药治疗失败的HCT后EBV+PTLD患者接受了Ebvallo治疗,并有机会进行6个月的随访。
通过独立肿瘤反应判定(IORA)评估,HCT组和SOT组的ORR为50% (19/ 38,95%CI: 33.4, 66.6)。完全缓解(CR)率为26.3%,部分缓解(PR)率为23.7%。所有患者的中位缓解时间(TTR)为1.1个月(0.7-4.7)。
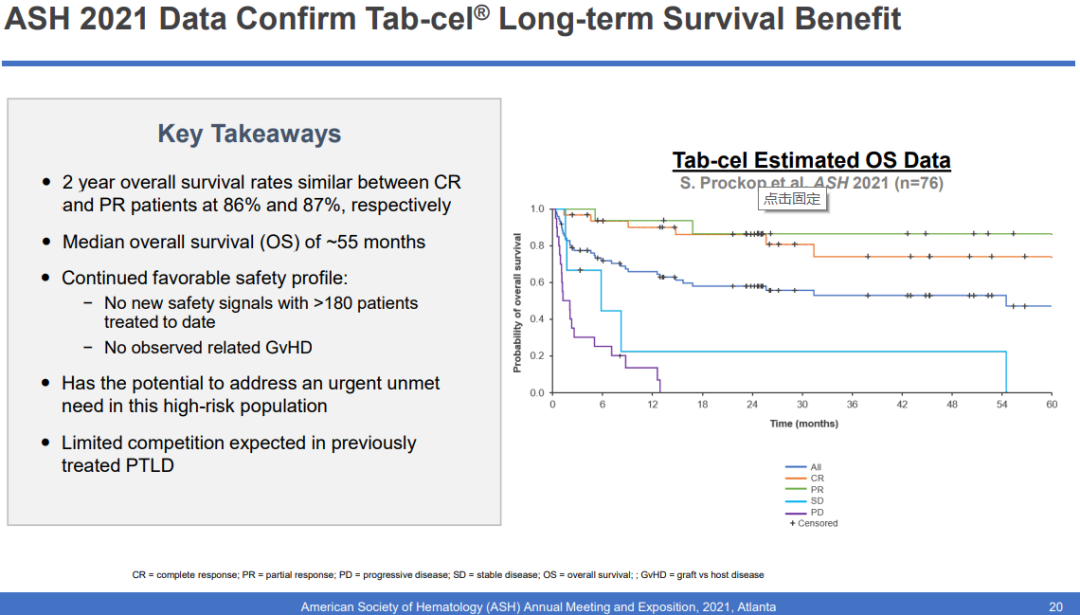
达到CR和PR患者的2年总生存率相当,分别为86%和87%,中位总生存期(OS)约为55个月。
鉴于CHMP的积极意见,欧盟委员会预计将在2022年底前批准Ebvallo的上市许可申请(MAA)。如果获得欧盟的批准,集中销售授权将在所有欧盟成员国以及冰岛、列支敦士登和挪威有效。此外,Atara将根据欧委会决策依赖程序(EC DRP)向英国药品和保健品监管局(MHRA)提交MAA,预计在2022年底前获得批准。根据现有的合作协议,Pierre Fabre将领导欧洲的所有商业化和分销活动。
Atara总裁兼首席执行官Pascal Touchon说 今日CHMP的积极意见是Atara公司first-in-class产品向前迈出的重要一步,该产品能够治疗一种超罕见和侵袭性癌症,这一疾病目前没有获得批准的疗法。同时这为我们独特的同种异体EBV T细胞平台提供进一步验证。如果获得批准,Ebvallo将成为首款同种异体T细胞疗法,并有可能改变复发或难治性EBV+PTLD患者的治疗模式,这些患者预后不良,中位生存期仅为几周至几个月。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















