Cell重磅:通过计算模型预测先导编辑效率及脱靶率,拓展其应用前景 |
 |
来源:生物世界 2023-05-10 17:23
这项发表在 Cell 的研究大规模分析了先导编辑效率数据,由此广泛表征了先导编辑的决定因素,并开发了一系列的计算模型来预测在多种细胞类型中不同先导编辑系统的效率,以及脱靶率。CRISPR基因编辑技术自问世以来,就展现出无可比拟的优势,并深刻改变了基因编辑领域乃至整个生命科学的研究模式。近年来,基于CRISPR系统开发的先导编辑(Prime Editing,PE)引起科学家们的关注,有望引领基因编辑的全新变革。
先导编辑是由刘如谦(David Liu)实验室于2019年开发的基因编辑系统,其最大的优势在于可以实现多样化编辑,包括基因点突变、基因插入、基因敲除以及多位点编辑等等。相比于传统的同源定向修复(HDR),PE无需DNA双链断裂(PE)即可实现编辑,因此安全性也更高。
然而,PE系统也存在编辑效率偏低、pegRNA设计复杂等缺点,并且需要先在各种实验条件下确定最有效的pegRNA,这将耗费大量的时间和资源。因此,目前许多研究正努力优化PE系统,克服这些现有的缺点。
近日,韩国延世大学医学院的Hyongbum Henry Kim教授团队在Cell期刊发表了题为:Prediction of efficiencies for diverse prime editing systems in multiple cell types的研究论文。
该研究以无误差的方式评估了总共338996对pegRNA的先导编辑(PE)效率,以此确定影响先导效率的因素。研究团队还进一步开发了名为DeepPrime、DeepPrime-FT和DeepPrime-OFF的计算模型,可以预测8种PE编辑系统在7种细胞类型中的编辑效率,以及先导编辑中脱靶效率。这些发现和计算模型的开发,将极大地促进先导编辑的应用。

先导编辑(PE)是一种能够实现任意碱基替换、DNA短片段插入和缺失、以及这些变化的组合的基因编辑技术,先导编辑器由PE向导RNA(pegRNA)、逆转录酶MMLV与nCas9组成。目前已经报道了多种PE系统,包括PE1、PE2、PE3、PE4、PE5。
值得一提的是,要想实现高效率的先导编辑,pegRNA的合理设计是其中的关键。pegRNA包括一个引导序列、tracrRNA支架、一个逆转录模板(RTT)和一个引物结合位点(PBS),在结构上可以说是相当的复杂。为了进行一次有效的先导编辑,研究团队需要设计成百上千个pegRNA、进行大量的实验,才能筛选到寥寥几个可以满足要求的pegRNA。
在这项最新研究中,研究团队通过高通量、无误差的方式使用五个不同的数据库评估了总共338996对pegRNA的PE效率。这种高通量评估使得研究人员能够广泛和系统地确定影响PE效率的因素。
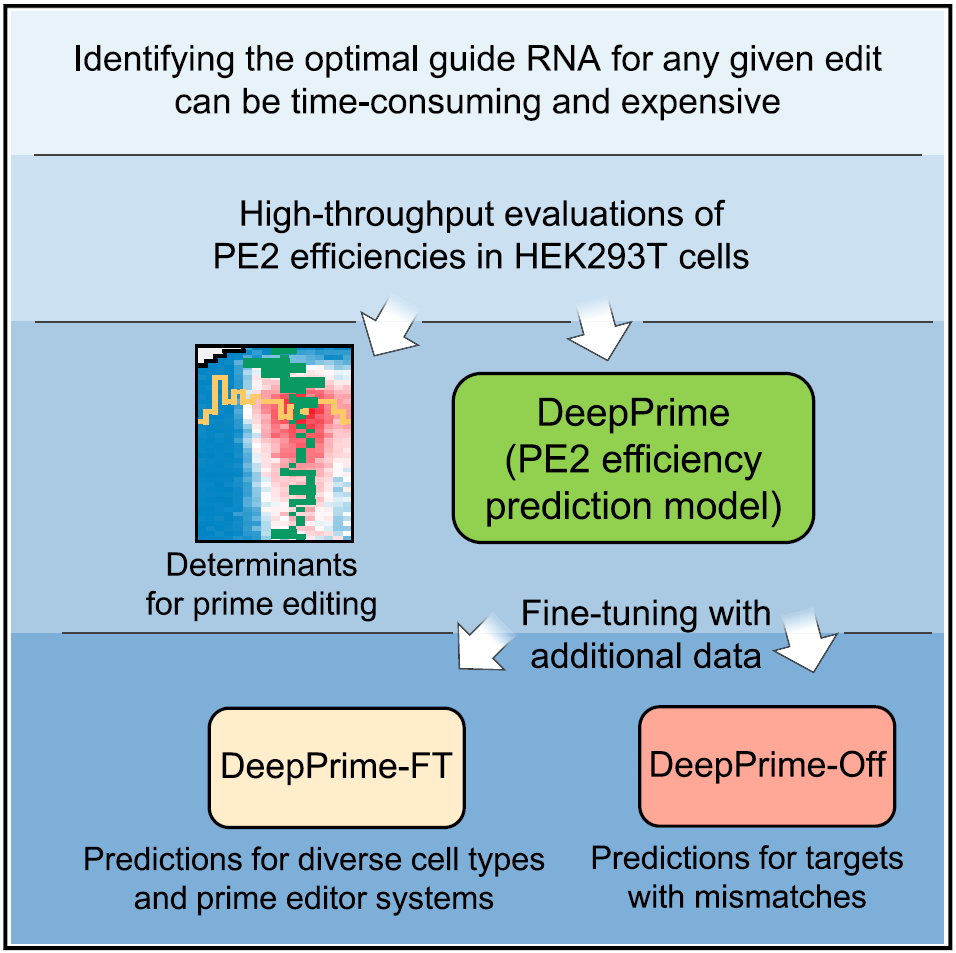
研究模式图
这些结果表明,PE效率会随着编辑核苷酸数量的增加而降低,特别是对于三个以上的核苷酸,其编辑效率会大大降低。此外,研究还发现,无论编辑类型和RTT长度如何,在高效PE编辑的最后一个模板化位置的首选核苷酸在C T A G的顺序排列。
研究团队总结了与PE效率相关的20个最重要的特征,包括PBS序列的熔解温度(Tm值)、GC含量、DeepSpCas9评分以及同源互补序列长度等等,并揭示这些因素是互相影响的,即每个因素的最佳范围通常取决于其他因素的水平。
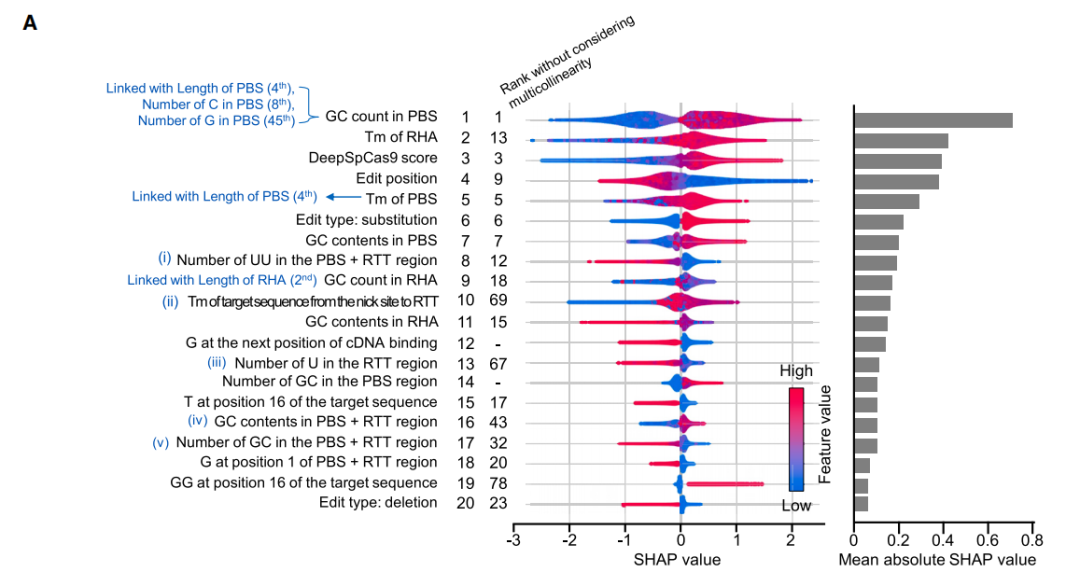
影响PE效率的相关特征
基于PE效率的大型数据集,研究团队开发了两个计算模型 DeepPrime和DeepPrime-FT,其设计的pegRNA使用优化的pegRNA支架、最佳协同编辑PAM序列和更高效的PE变体,不仅提高了PE系统的编辑效率,还可以准确预测7种不同细胞类型中所有可能的编辑类型组合的各种PE系统的效率。
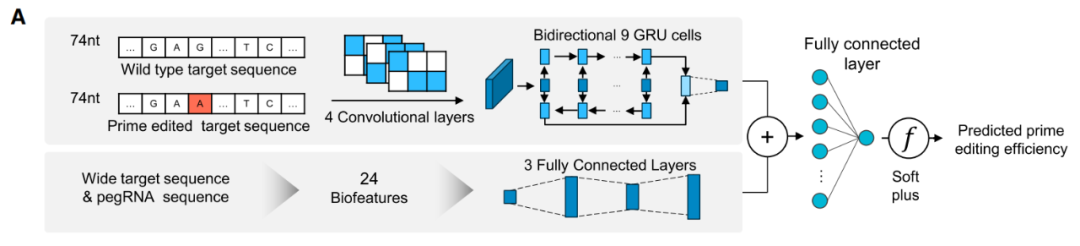
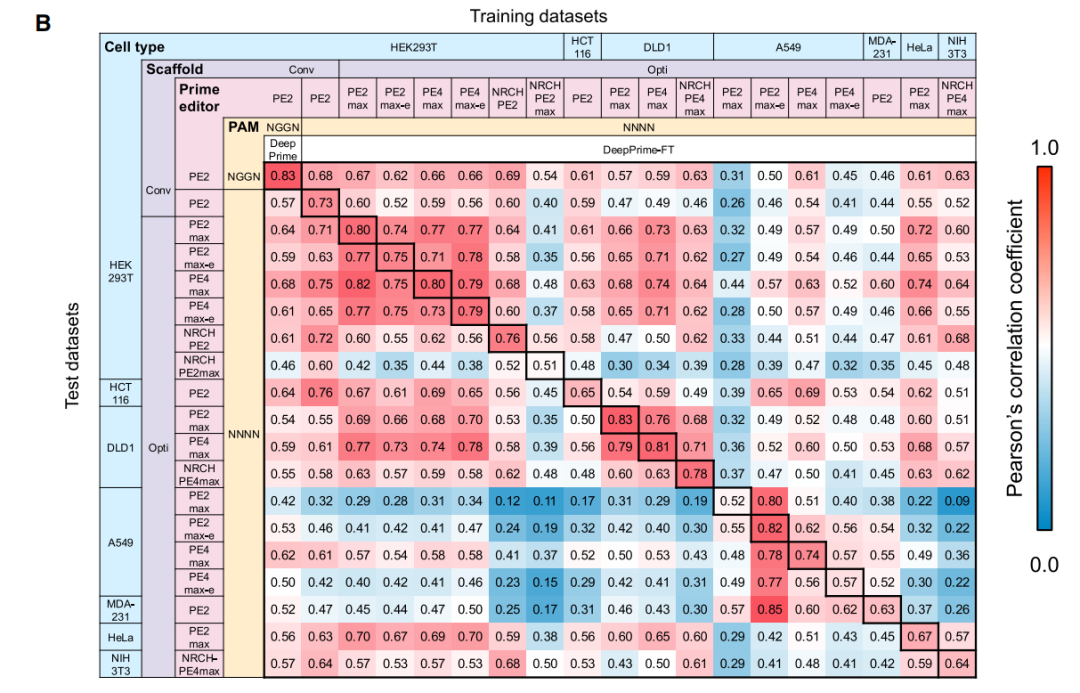
开发用于预测PE编辑效率的计算模型
为了验证其实用性,研究团队测试了DeepPrime和DeepPrime-FT是否可以生成编辑效率更高的、用于纠正致病性突变的pegRNA:与合理设计的pegRNA相比,基于DeepPrime的pegRNA设计可以将平均编辑效率提高2.1倍,而对于DeepPrime-FT来说,这一数值为5.7倍。

计算模型预测的pegRNA具有更高的PE编辑效率
不仅如此,研究团队还广泛地分析了PE系统的脱靶率,并开发了一个计算模型 DeepPrime-OFF用于预测不匹配目标序列的PE效率,并证明DeepPrime-OFF有助于减少潜在的脱靶位点的数量,并确定应该测试的pegRNA的优先级。
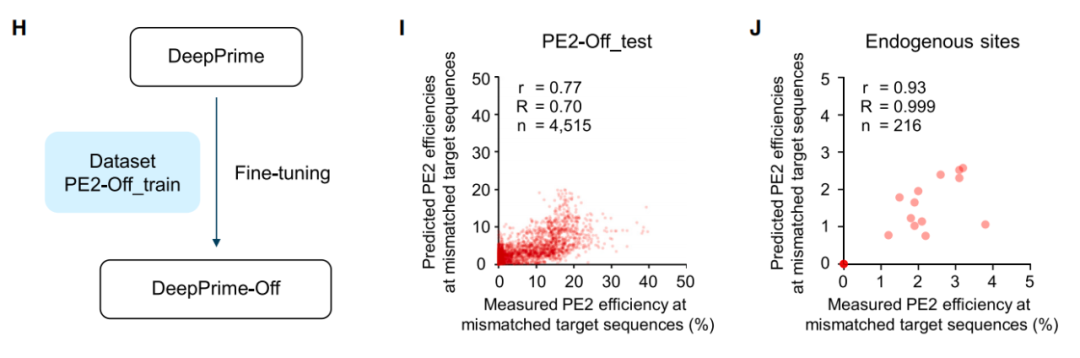
DeepPrime-OFF用于预测不匹配目标序列的PE效率
总而言之,这项发表在Cell的研究大规模分析了先导编辑效率数据,由此广泛表征了先导编辑的决定因素,并开发了一系列的计算模型来预测在多种细胞类型中不同先导编辑系统的效率,以及脱靶率。通过这些计算模型,科学家们可以通过计算预测先导编辑和pegRNA的不同组合在匹配或不匹配的目标序列处的编辑效率,以选择最有效和最具体的组合。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:为何男性和吸烟者更易患膀胱癌? (2025-10-13)
- AJRCCM:血液里的“预警信号”!科学家发现肺纤维化早期检测新希望 (2025-10-13)
- Pediatr Investig:被忽视的儿童基孔肯雅热,蚊子叮一口,为何让孩子更受伤? (2025-10-13)
- Nature Genetics:昌平实验室赵亚杰等揭示肥胖与2型糖尿病新的风险基因 (2025-10-13)
- Science:肿瘤微环境的“酸”爽真相!癌细胞的能量代谢“变奏曲” (2025-10-13)
- 《细胞·代谢》:刷新认知!中国科学家首次发现,精子miRNA可作为表观遗传信息载体,实现父代运动能力代际遗传 (2025-10-13)
- 【10月16日直播预告】科研加速度!百趣生物新一代代谢组学NGM 3新品发布会 (2025-10-13)
- Cancer Cell:浙江大学梁廷波团队发布序贯新辅助化疗方案治疗胰腺癌的3期临床数据 (2025-10-12)
- 广州国家实验室论文登上Cell Stem Cell封面:成功构建高保真人类着床后胚胎模型 (2025-10-12)
- 15亿美元,BMS收购一家in vivo CAR-T公司,诺奖得主与华人学者联合创立,利用环状RNA在体内生成CAR-T细胞 (2025-10-12)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















