Science:揭示蛋白激酶PIM1控制GBP1 蛋白活性机制,有望开发出针对传染病和癌症的新疗法 |
 |
来源:100医药网原创 2023-10-15 15:28
一种称为GPB1的蛋白能够攻击受感染细胞中的微生物。GBP1 在炎症过程中被激活,有可能攻击细胞膜并破坏它们。在一项新的研究中,来自英国伯明翰大学和弗朗西斯-克里克研究所等研究机构的研究人员发现了一种一种称为GPB1的蛋白能够攻击受感染细胞中的微生物。GBP1 在炎症过程中被激活,有可能攻击细胞膜并破坏它们。在一项新的研究中,来自英国伯明翰大学和弗朗西斯-克里克研究所等研究机构的研究人员发现了一种控制蛋白GPB1的 保护机制 ,这就为开发针对弓形虫、衣原体、结核病甚至癌症的新疗法提供了可能。相关研究结果发表在2023年10月6日的Science期刊上,论文标题为 PIM1 controls GBP1 activity to limit self-damage and to guard against pathogen infection 。

这些作者揭示了这种攻击细胞中微生物的蛋白如何通过一种叫做磷酸化的过程加以控制,在这种过程中,一种叫做蛋白激酶的酶会在蛋白上添加一个磷酸基团。靶向GBP1 的激酶被称为 PIM1,在炎症期间也会被激活。磷酸化的 GBP1 反过来又与一种支架蛋白结合,使未感染的旁观者细胞免受不受控制的 GBP1细胞膜攻击和细胞死亡。这种新发现的锁-钥机制可以防止GPB1不加选择地攻击细胞膜,从而形成一种对细胞内病原体的破坏敏感的保护机制。
论文通讯作者、伯明翰大学高级研究员Eva Frickel博士补充说, 这一发现意义重大,原因有几个。首先,像控制 GBP1 这样的防护机制已知存在于植物生物学中,但在哺乳动物中却鲜为人知。可以把它想象成一把锁-钥系统。GPB1想出去攻击细胞膜,但PIM1是钥匙,这意味着GPB1被安全地锁在外面。第二个原因是,这一发现可能具有多种治疗用途。如今我们知道了 GBP1 是如何被控制的,我们就可以探索随意开启和关闭这一功能的方法,利用它来杀死病原体。
Frickel博士和她的研究团队对弓形虫进行了初步研究,其中弓形虫是一种常见于猫体内的单细胞寄生虫。在欧洲和西方国家,弓形虫感染不太可能导致严重疾病,但在南美国家,弓形虫感染可能导致复发性眼部感染和失明,对孕妇尤其危险。
这些作者发现弓形虫会阻断细胞内的炎症信号传导,阻止 PIM1 产生,这意味着这种 锁-钥 系统消失了,GBP1被释放出来并去攻击弓形虫。用或操纵细胞基因组来 关闭 PIM1,也会导致GPB1攻击弓形虫并清除受感染的细胞。
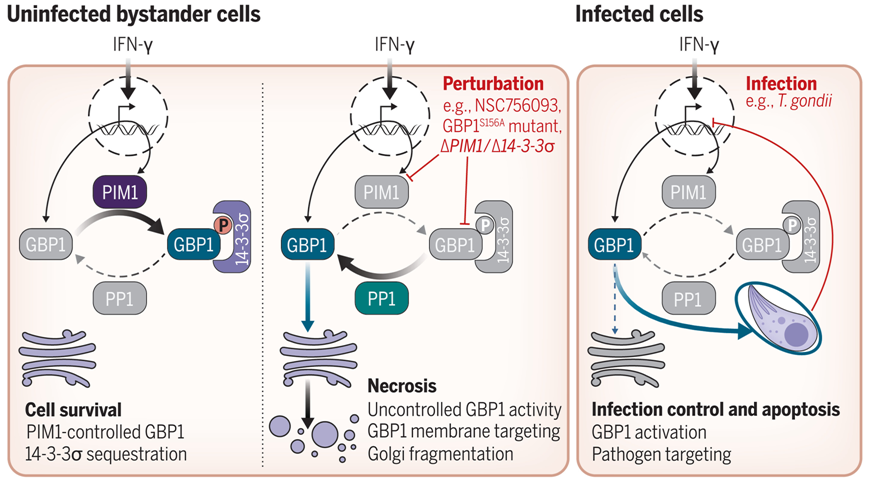
蛋白激酶PIM1控制GBP1的活性。图片来自Science, 2023, doi:10.1126/science.adg2253。
Frickel博士继续说, 这种机制也可能作用于其他病原体,如衣原体、结核分枝杆菌和葡萄球菌等,这些主要的致病病原体对的耐药性越来越强。通过控制这种保护机制,我们就可能利用这种攻击细胞中微生物的蛋白消灭体内的病原体。我们已经开始寻找这个机会,看看我们是否能够重现我们在弓形虫实验中观察到的情况。我们还对如何利用这种方法杀死感到无比兴奋。
PIM1 是癌细胞存活的关键分子,而 GPB1 则会被癌症的炎症效应激活。这些作者认为,通过阻断PIM1和GPB1之间的相互作用,他们就可能针对性地消灭癌细胞。
Frickel博士说, 这对癌症治疗意义重大。我们认为这种保护机制在癌细胞中是活跃的,因此下一步就是要探索这一点,看看我们能否阻断这种保护机制,有选择性地消灭癌细胞。市场上有一种抑制剂,我们用它来破坏 PIM1 和 GPB1之间的相互作用。因此,如果这种方法奏效,就可能使用这种药物来解除对 GPB1的抑制并攻击癌细胞。虽然还有很长的路要走,但 PIM1的这种保护机制可能是寻找治疗癌症和抗生素耐药性越来越强的病原体的新方法的重要第一步。 ( 100yiyao.com)
参考资料:
1. Daniel Fisch et al. . Science, 2023, doi:10.1126/science.adg2253.
2. New discovery may unlock the future of infectious disease and cancer treatment
https://www.birmingham.ac.uk/news/2023/new-discovery-may-unlock-the-future-of-infectious-disease-and-cancer-treatment
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















