华海拿下15个重磅品种,集采品种暴涨450% |
 |
在过去的2023年,华海药业国内外均收获颇丰:15个新品获批生产,总过评品种数扩容至54个;在美拿下9个ANDA文号,总获批ANDA号达90余个。2023前三季度华海药业研发费用6.67亿元,目前公司主要有16款创新药(13款1类新药)在研,2个单抗上市可期,此外51个新分类申报品种在审。
拿下15个新品!4大“光脚”品种备战第十批集采
2023年12月21日,国家药监局官网显示,华海药业申报的4类仿制药拉考沙胺片获批生产并视同过评。今年以来,公司已有15个品种首次获批生产并视同过评,涵盖神经系统、心脑血管系统、全身用抗感染等治疗领域。
2023年华海药业获批上市的仿制药
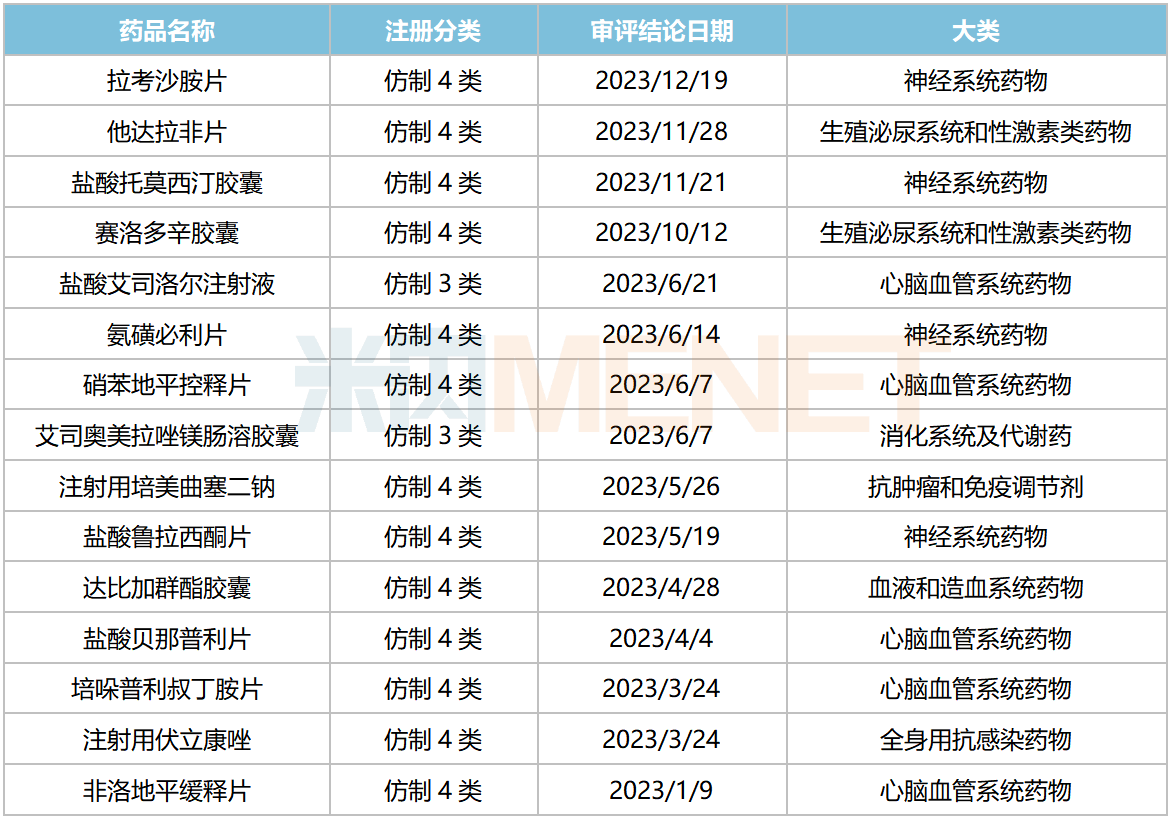
来源:米内网中国申报进度(MED)数据库
从市场规模看,15个品种2022年在中国三大终端六大市场(统计范围详见本文末)的销售额合计超过220亿元,包括他达拉非片(20亿+)、硝苯地平控释片(75亿+)、注射用培美曲塞二钠(32亿+)、注射用伏立康唑(24亿+)、非洛地平缓释片(33亿+)等大品种。
截至目前,华海药业已有54个品种过评/视同过评,其中15个品种为首家过评,赖诺普利片、福辛普利钠片、奈韦拉平片等为独家过评。从治疗领域看,54个品种涉及8大治疗领域,集中在神经系统药物(21个)、心脑血管系统药物(16个)等。
华海药业过评情况
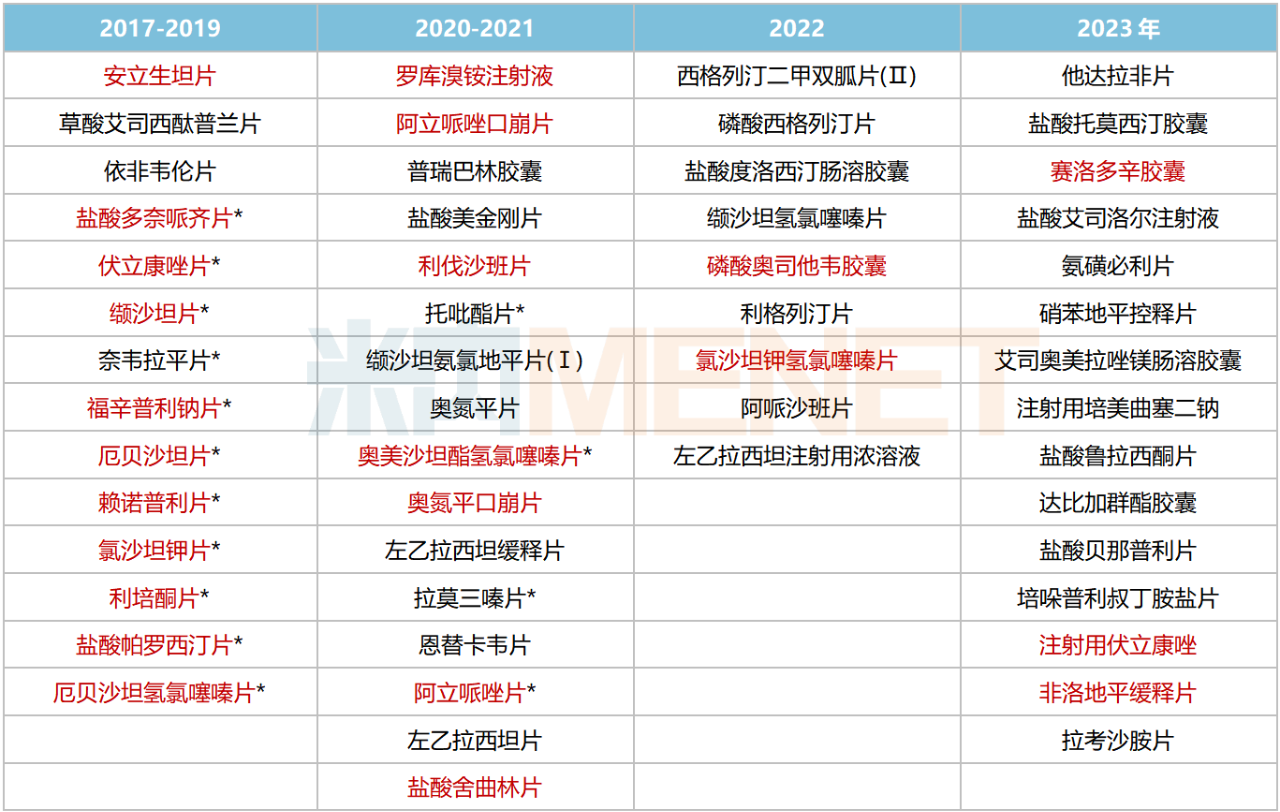
注:带*为首家/独家过评,标红为国采中选
来源:米内网一致性评价进度数据库
在已落地执行的八批九轮化药集采中,华海药业分别有7个、2个、3个、1个、2个、3个、3个、2个品种中标,合计23个品种。集采中标品种快速放量,推动了公司国内制剂业务销售大幅增长,如第三批集采品种奥氮平口崩片,华海药业的产品2023上半年在中国公立医疗机构终端的销售额增速约达450%,市场份额由2020年的0.08%提升至2023上半年的23.21%。
目前华海药业已过评但未纳入集采的品种有9个,其中5个已满足5家及以上的充分竞争条件,其中艾司洛尔注射剂、西格列汀口服常释剂型、利格列汀口服常释剂型2022年在中国公立医疗机构终端的销售额均超过10亿元。
值得一提的是,华海药业2022年在艾司洛尔注射剂、西格列汀口服常释剂型、西格列汀二甲双胍口服常释剂型、利格列汀口服常释剂型4个品种中所占市场份额均为0。
华海药业过评但未集采且已满足5家及以上条件的品种
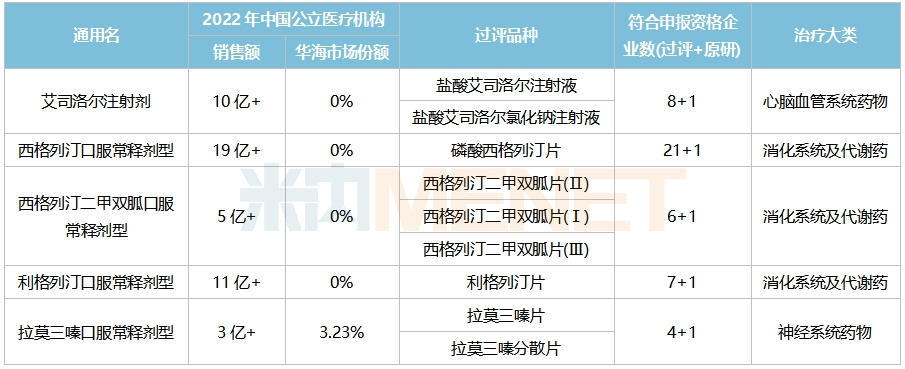
来源:米内网综合数据库
13款1类新药来势汹汹,51个新品冲刺上市
近年来,华海药业持续加快产业转型升级步伐,不断提升研发创新能力,加速生物药和创新药发展。据季报数据,2023前三季度公司研发费用6.67亿元,占营收比重10.75%。
目前华海药业有16款新药在国内处于申请临床及以上阶段,聚焦抗肿瘤、自身免疫、神经系统等治疗领域,其中1类新药有13个。从药物类型看,12个为生物药,4个为化学药。
华海药业国内在研新药
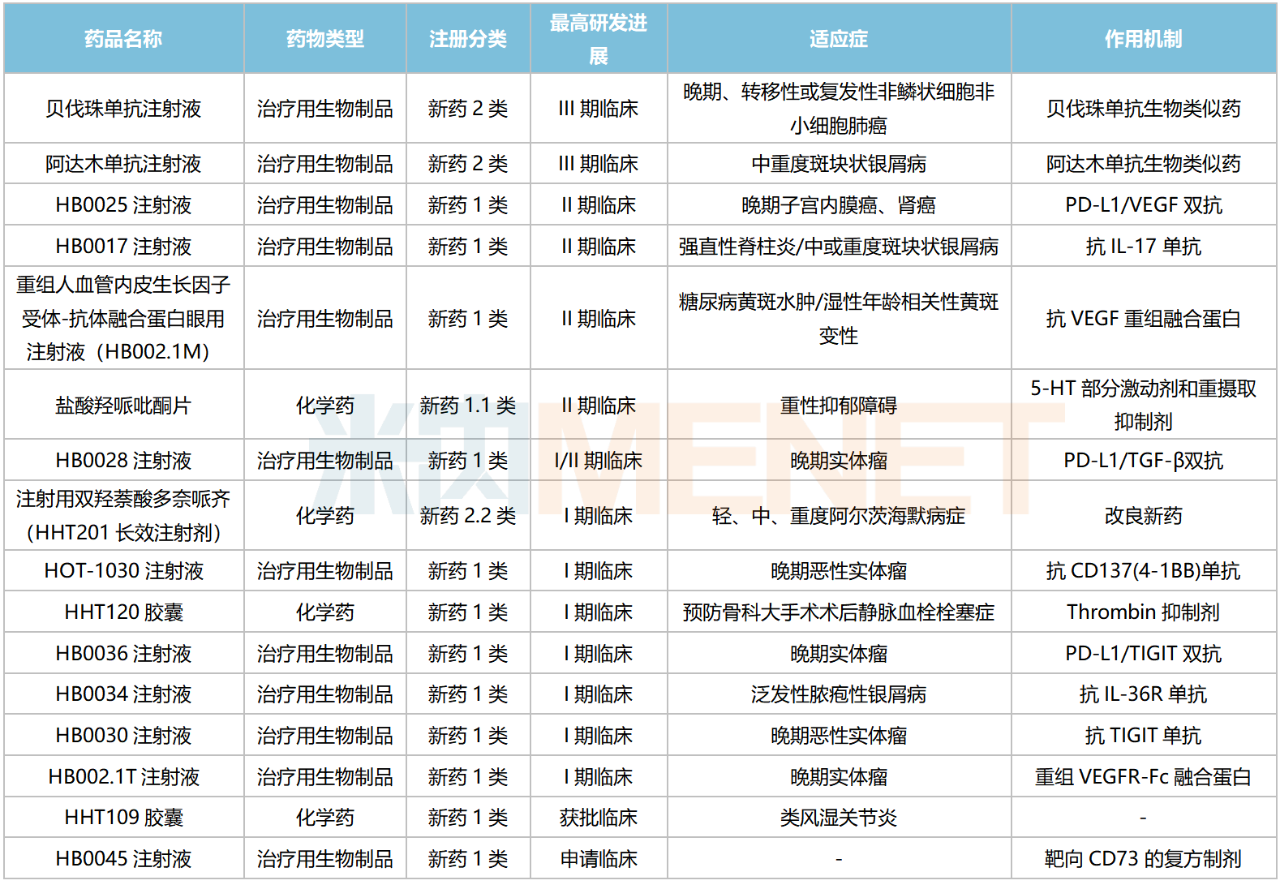
来源:米内网综合数据库
生物药是华海药业重点布局的方向,其中2款生物类似药——阿达木单抗注射液、贝伐珠单抗注射已步入III期临床,上市可期。米内网数据显示,上述两款单抗2022年在中国三大终端六大市场的销售额分别超过20亿元、86亿元。
公司有多款双抗在研,其中HB0025注射液(PD-L1/VEGF双抗)进展最快,其晚期子宫内膜癌、肾癌等适应症已步入II期临床;此外,HB0028注射液(PD-L1/TGF-β双抗)正在开展晚期实体瘤的I/II期临床,HB0036注射液(PD-L1/TIGIT双抗)正在开展晚期实体瘤的I期临床。
仿制药方面,目前华海药业有51个品种以新注册分类申报且在审(以药品名称计,不含已有批文品种),涵盖9个治疗领域,主要集中在神经系统药物(13个)、消化系统及代谢药(13个,12个为糖尿病用药)、心脑血管系统药物(10个,9个为高血压用药)等。
华海药业新分类申报且在审的品种

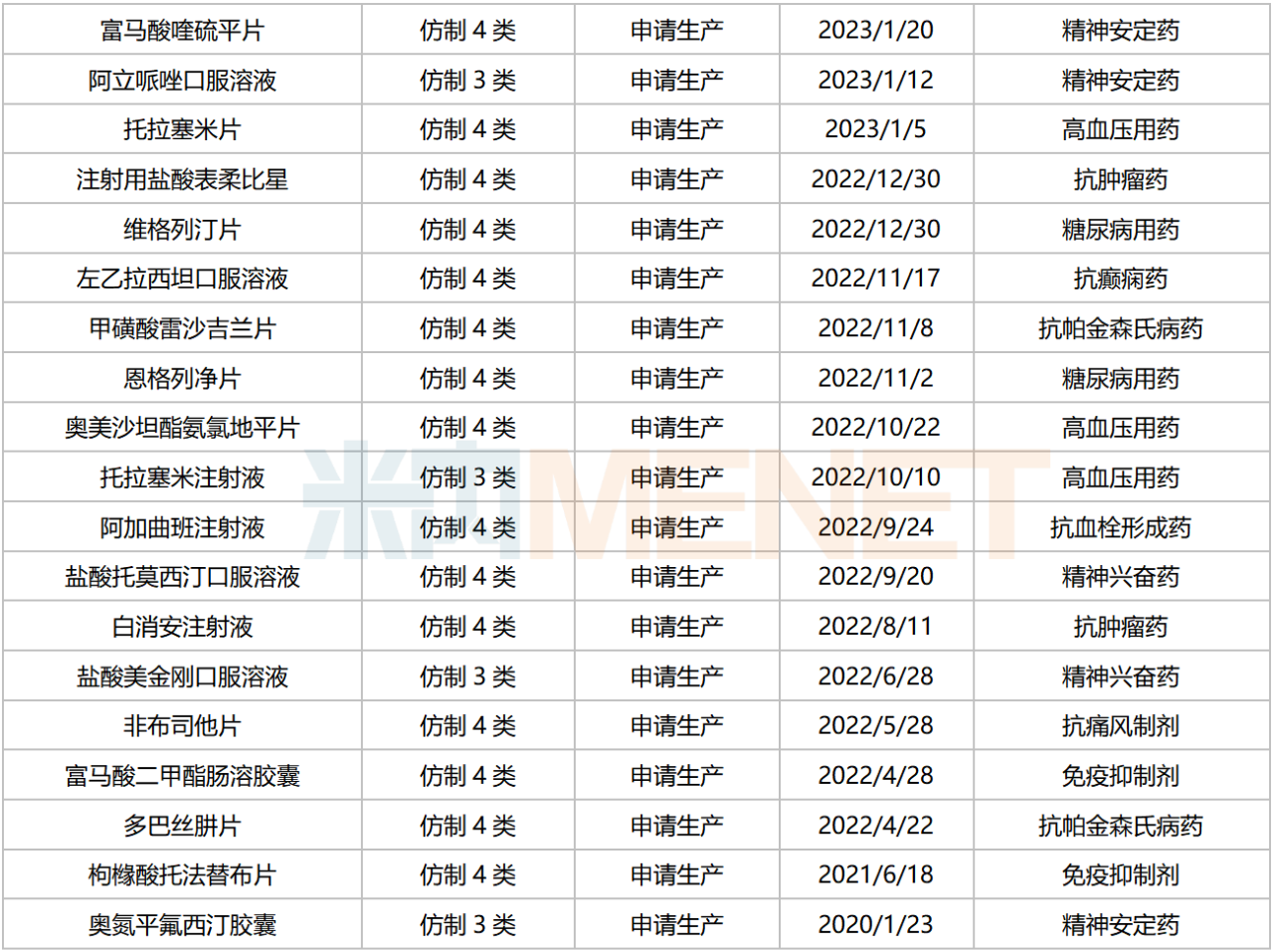
来源:米内网中国申报进度(MED)数据库
坎地沙坦酯氢氯噻嗪片、布瓦西坦片、达格列净二甲双胍缓释片、卡左双多巴缓释片、艾拉戈利钠片等品种暂无首仿(含剂型首仿)获批上市。此外,阿戈美拉汀片、甲氨蝶呤注射液、富马酸二甲酯肠溶胶囊、奥氮平氟西汀胶囊等品种目前仅1家国产企业获批。
9个ANDA文号获批,创新药“出海”持续推进
自成立之初,华海药业就聚焦和深耕海外市场,是国内制药企业拓展国际市场的先导企业。
华海药业是国内首家通过美国FDA制剂认证的企业,深耕美国市场近二十年,华海品牌已被美国主流市场所认可。据半年报数据显示,2023上半年公司美国制剂业务的销售收入同比增长73.3%。
米内网数据显示,2023年华海药业有9个ANDA文号获得FDA批准/暂定批准,涵盖神经系统、心脑血管系统等多个治疗领域。迄今为止,华海药业已有90余个ANDA文号获得FDA批准,其中有多个产品在美国市场占有率名列前茅。
2023年华海药业在美国获批的ANDA
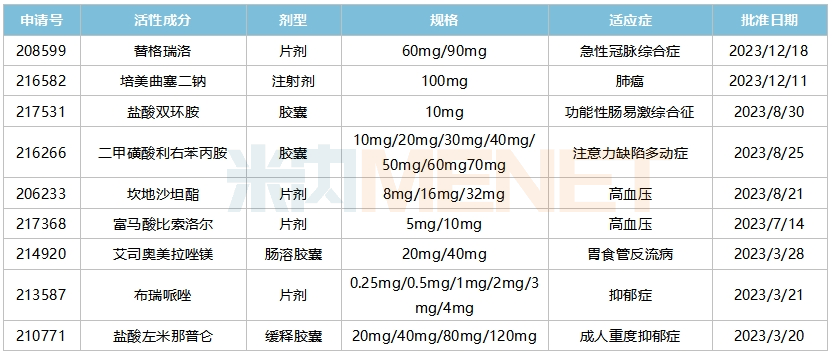
来源:米内网美国FDA数据库
创新药方面,2023年华海药业自主研发的创新药注射用HB0052(CD73 ADC)获得美国FDA批准,可开展晚期实体瘤的临床试验;HB0034注射液(抗IL-36R单抗)获得美国FDA孤儿药认定,用于治疗泛发性脓疱型银屑病(GPP),该新药已在新西兰开展临床试验;HB0025注射液(PD-L1/VEGF双特异性融合蛋白)联合HB0030注射液(抗TIGIT单抗)的Ib/II期临床试验获得FDA批准,适应症为晚期实体瘤。
2023年华海药业发布的创新药在美研发进展的公告

来源:公司公告,米内网整理
据不完全统计,目前华海药业至少有6款新药在美国处于获批临床及以上阶段,包括注射用HB0052(CD73 ADC)、HB0025注射液(PD-L1/VEGF双特异性融合蛋白)、HB0045注射液(靶向CD73的复方制剂)、HB0036注射液(PD-L1/TIGIT双抗)、HB0017注射液(抗IL-17单抗)、HHT201等。
资料来源:米内网数据库、公司公告等
注:米内网《中国三大终端六大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至1月10日,如有疏漏,欢迎指正!
医药网新闻
- 相关报道
-
- 湖南:严把中药材泉源平安关 (2025-10-15)
- 做好2025年江西省垣乡住民根本医疗保证无关任务 (2025-10-15)
- “医护上门”托起幸福晚年——重庆潼南推进聪明医养“一键点单” (2025-10-14)
- 30省份85家医疗机构“组团”共匆匆儿童青少年生理安康 (2025-10-14)
- 世卫组织:抗生素耐药性成绩对环球安康组成威逼 (2025-10-14)
- 山西榆社摸索“医养交融”新途径 让“银发族”老有所依更病有所医 (2025-10-13)
- 年夜病住院最多可报55万元 湖南启动2026年度医保参保发动 (2025-10-13)
- 广州为医疗东西立异产物开明“绿色通道” (2025-10-13)
- 以“药”为媒 “中国药都”江西樟树出力打造西医药“生态圈” (2025-10-11)
- 上海生物医药家当规模预计本年破万亿元 (2025-10-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















