Nature子刊:浙江大学刘婷团队揭示BRCA1/2缺陷细胞通过复制叉稳定性重建导致PARP抑制剂耐药的新机制 |
 |
Nature子刊:浙江大学刘婷团队揭示BRCA1/2缺陷细胞通过复制叉稳定性重建导致PARP抑制剂耐药的新机制
来源:生物世界 2024-04-25 09:24
该研究首次报道了UFMylation参与调节复制叉稳定性的功能与机制;系统阐明了UFMylation促进BRCA1/2缺陷细胞中新生DNA链在复制压力下发生降解的分子生物学过程。浙江大学基础医学院刘婷课题组(研究助理田甜为论文第一作者)在Nature Chemical Biology期刊发表了题为:UFL1 triggers replication fork degradation by MRE11 in BRCA1/2-deficient cells的研究论文。
该研究发现,在复制压力下,E3连接酶UFL1催化PTIP蛋白发生UFMylation修饰,促进BRCA1/2缺陷细胞中新生DNA链的降解。这一分子机制表明,BRCA1/2缺陷细胞可以通过失活UFMylation通路来重建复制叉稳定性,从而对PARP抑制剂产生耐药。这也是国际上首次报道UFMylation参与复制叉稳定性维持的功能与分子机制。

复制压力发生时,解旋酶与聚合酶发生解偶联或受到核酸酶修剪,导致停滞的复制叉暴露出单链DNA(ssDNA),并与单链结合蛋白RPA复合体结合;随后,重组酶RAD51置换RPA,形成ssDNA-RAD51复合物。接着,在转位酶(Translocase)如SMARCAL1、ZRANB3、HLTF和PICH,以及DNA拓扑异构酶TOP2A和SUMO E3连接酶ZATT等的协作催化下,新生子链DNA经过两步翻转并退火。此时,复制叉形成四叉的霍利迪交叉(Holliday Junction)结构,从而暂时稳定了停滞复制叉。该过程中,RAD51促进复制叉翻转的过程,与解旋酶BLM所推动的复制叉重启相拮抗。
刘婷课题组于2024年2月在Nature Communications发表的研究论文报道了TFIP11蛋白结合到停滞复制叉上,通过竞争性抑制BLM与复制叉的结合,促使RAD51与复制叉结合,并促进复制叉翻转的分子生物学机制。此外,为了维持复制的稳定性,停滞复制叉必须防止核酸内切酶SLX4复合物被过度招募其上,切割复制叉并导致复制叉崩塌。他们还于2024年4月在The EMBO Journal期刊发表论文,报道了ssDNA-RPA复合物所招募的ATR激酶如何阻止SLX4核酸酶复合体的过度募集,从而避免复制叉崩塌的分子机制。
BRCA1/2蛋白在复制叉稳定性维持中也发挥关键作用。当翻转发生时,重组酶RAD51与翻转链的结合需要被BRCA1/2稳定,以保护新生DNA链免受MRE11等核酸酶的降解。在BRCA1/2缺陷的中,由于复制叉无法维持其稳定性,这些细胞对PARP抑制剂表现出高度敏感,导致合成致死。
UFMylation是一种类泛素化修饰,其修饰遵循与泛素化修饰相似的E1-E2-E3级联反应过程,将类泛素蛋白UFM1(Ubiquitin-fold modifier 1)共价连接到底物蛋白的赖氨酸残基上,其中UFL1(UFMylation E3-like ligase 1)是目前唯一已知的E3连接酶。自2004年发现UFMylation以来,尽管这一翻译后修饰已被证明在调节胚胎发育、内质网稳态和基因组完整性等方面具有重要意义,但迄今为止,已发现的UFMylation底物十分有限,此前尚未有过UFMylation参与复制叉稳定性调控的报道。
刘婷课题组的这项研究中发现,在BRCA1/2缺陷的细胞中,当UFMylation的E3连接酶UFL1被敲减时,部分恢复了由PARP抑制剂所引起的基因组不稳定性,并证明该表型的出现并非由于同源重组修复被重建,而是由于在复制压力下,新生DNA链不再受到降解。进一步的研究表明,在BRCA1/2缺陷的细胞内,UFL1催化核酸酶MRE11的关键招募蛋白PTIP发生第148位赖氨酸(K148)的UFMylation修饰。而PTIP蛋白的UFMylation修饰则进一步促进了PTIP- MLL3/4甲基转移酶复合体的组装,进而使得停滞复制叉处组蛋白H3K4的甲基化水平显著增加。核酸酶MRE11随后响应该甲基化信号,被招募到停滞复制叉上,降解新生DNA。
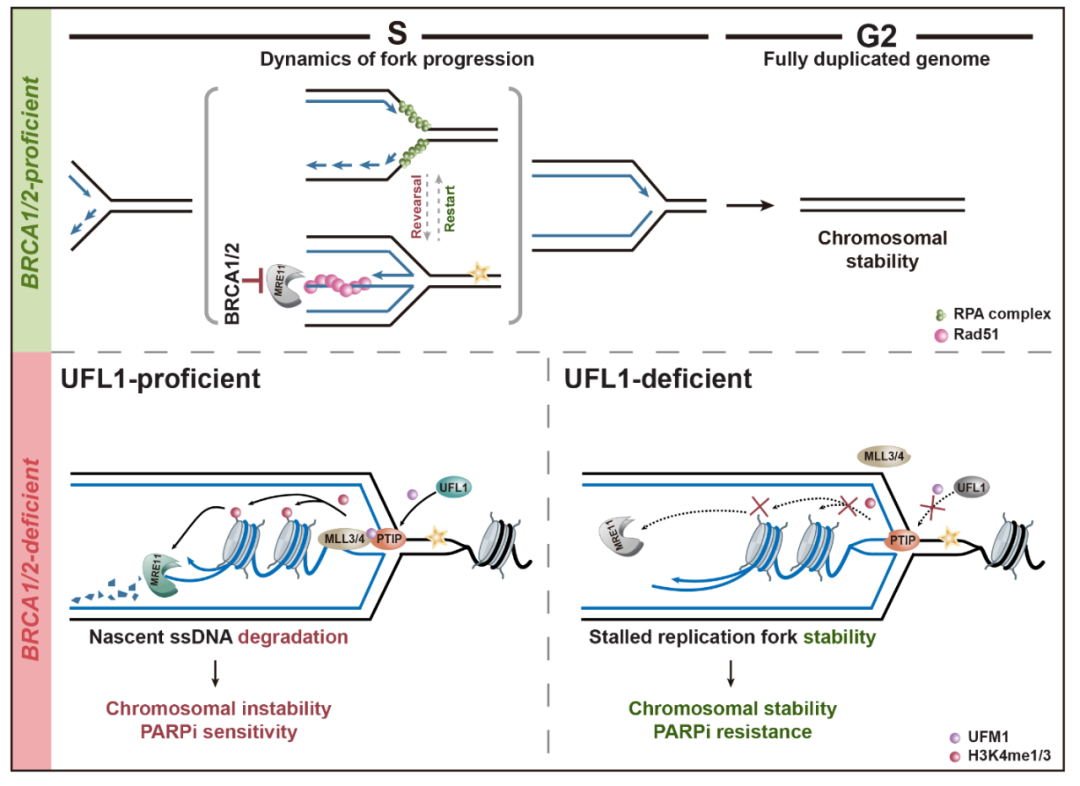
综上所述,该研究首次报道了UFMylation参与调节复制叉稳定性的功能与机制;系统阐明了UFMylation促进BRCA1/2缺陷细胞中新生DNA链在复制压力下发生降解的分子生物学过程;并深入揭示了当UFL1缺失时,核酸酶MRE11无法降解新生DNA链,从而重建复制叉稳定性,使细胞对PARP抑制剂产生耐药性的分子机制。据悉,深圳大学许兴智教授团队在PNAS发表论文也将报道UFL1通过催化PARP1的UFMylation,从而调控复制叉稳定性维持。
刘婷课题组致力于研究DNA损伤应答与基因组不稳定性的分子机制研究,1)应用细胞分子生物学、生物化学、、结构生物学等多种实验手段,阐明细胞应答DNA损伤、维持基因组稳定性的分子机制;2)应用基础研究与疾病模型相结合的方式深入研究与DNA损伤应答异常相关疾病(如肿瘤等)发生的分子机制;3)从DNA损伤应答系统入手探寻对肿瘤等相关疾病进行治疗的最佳靶向方式。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















