PNAS: STAT1苏氨酸磷酸化抑制干扰素信号转导并促进先天炎症反应 |
 |
来源:100医药网 2024-05-19 11:14
在本研究中,研究者利用遗传和生化分析,揭示了Thr748是STAT1中一个保守的干扰素非依赖性磷酸化开关,它限制干扰素信号转导,并在识别细菌衍生毒素脂多糖(LPS)后促进先天炎症反应。在多细胞生物体中,细胞通过利用信号分子网络作为传感器、信息处理器和效应器来识别和响应环境,从而做出适当的反应。这在宿主-病原体相互作用和先天信号的背景下得到了最好的说明。三十多年前,关于干扰素(IFN)抗病毒机制的实验发现了Janus Kinase(JAK)信号转导和转录激活因子(STAT)途径,这是膜到核信号传递的典范。STAT蛋白一直是我们了解先天免疫系统乃至更广泛的免疫系统的核心。
经典的JAK-STAT信号假设STAT蛋白在细胞质中保持潜伏,直到在其C末端反式激活结构域(TAD)内的关键酪氨酸残基上被磷酸化,这是由受体相关的JAK复合体介导的。在哺乳动物中,STAT家族由7个进化保守的蛋白质组成:STAT1、2、3、4、5a、5b和6。
STAT1广泛表达,由一个全长 亚型及其剪接变异体 组成,它缺少其TAD的最后38个氨基酸,这表明这些氨基酸可能对STAT1转录活性的特异性起到了作用。JAK介导的STAT1的Tyr701磷酸化是所有类型的干扰素信号和干扰素刺激基因(ISGs)转录的中心。一些翻译后修饰,如708和727上的丝氨酸磷酸化,有助于干扰素刺激后STAT1转录活性的选择性。
先天免疫反应依赖于通过模式识别受体识别病原体上进化上保守的结构,称为病原体相关分子模式,其中Toll样受体(Toll-like Receptor,TLRs)家族的研究最为广泛。TLRs可以根据它们在细胞表面的定位进行分类,如位于质膜上的TLR1、2、4、5和6,识别检测到TLR3、7、8和9等核酸的微生物细胞表面分子或内体。TLRs的这种空间调控对下游信号激活和最终不同的下游基因表达至关重要。表面TLRs激活NF- B信号和炎症反应,而内体TLRs激活IRFs和I型干扰素反应。

图片来源:https://doi.org/10.1073/pnas.2402226121
近日,来自大阪大学免疫学前沿研究中心的研究者们在PNAS杂志上发表了题为 Threonine phosphorylation of STAT1 restricts interferon signaling and promotes innate inflammatory responses 的文章,该研究揭示了STAT1苏氨酸磷酸化抑制干扰素信号转导并促进先天炎症反应。
自三十多年前发现以来,信号转导和转录激活因子1(STAT1)作为干扰素(IFN)信号转导和抗病毒防御的中枢介质得到了广泛的研究。在本研究中,研究者利用遗传和生化分析,揭示了Thr748是STAT1中一个保守的干扰素非依赖性磷酸化开关,它限制干扰素信号转导,并在识别细菌衍生毒素脂多糖(LPS)后促进先天炎症反应。
表达缺磷苏氨酸748-丙氨酸(T748A)突变STAT1的基因工程小鼠对脂多糖诱导的致死性具有抵抗力。值得注意的是,T748A小鼠表现出未受干扰的干扰素信号,以及STAT1的总表达。此外,STAT1的T748A点突变概括了STAT1在脂多糖诱导的致死后基因消融的保护作用,表明Thr748的磷酸化参与了STAT1的炎症功能。
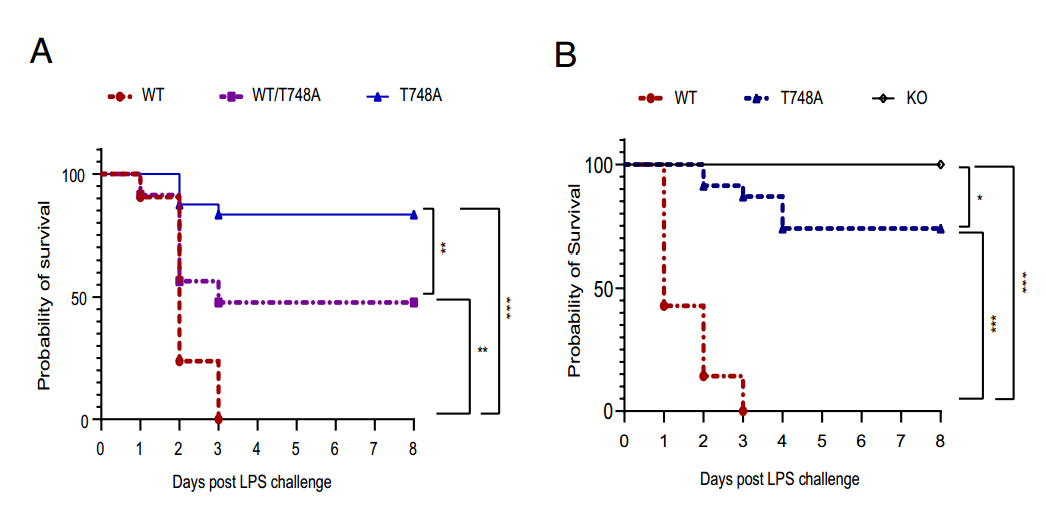
阻断Thr748磷酸化重现脂多糖致死后STAT1基因消融的保护作用
图片来源:https://doi.org/10.1073/pnas.2402226121
在机制上,内毒素诱导的Toll样受体4内吞激活细胞内固有的I B激酶介导的信号转导蛋白1的Thr748磷酸化,从而促进巨噬细胞的炎症反应,同时限制干扰素和抗炎反应。耗尽巨噬细胞可恢复T748A小鼠对内毒素诱导的致死反应的敏感性。
总之,本研究表明,STAT1在先天性免疫反应中具有依赖于磷酸化的模块化功能:干扰素磷酸化酪氨酸依赖性和炎症性磷酸化苏氨酸依赖性。更好地了解STAT1的Thr748磷酸化可能会发现先进的药理靶向分子,并为败血症提供更好的治疗方式。败血症每年夺走数百万人的生命。
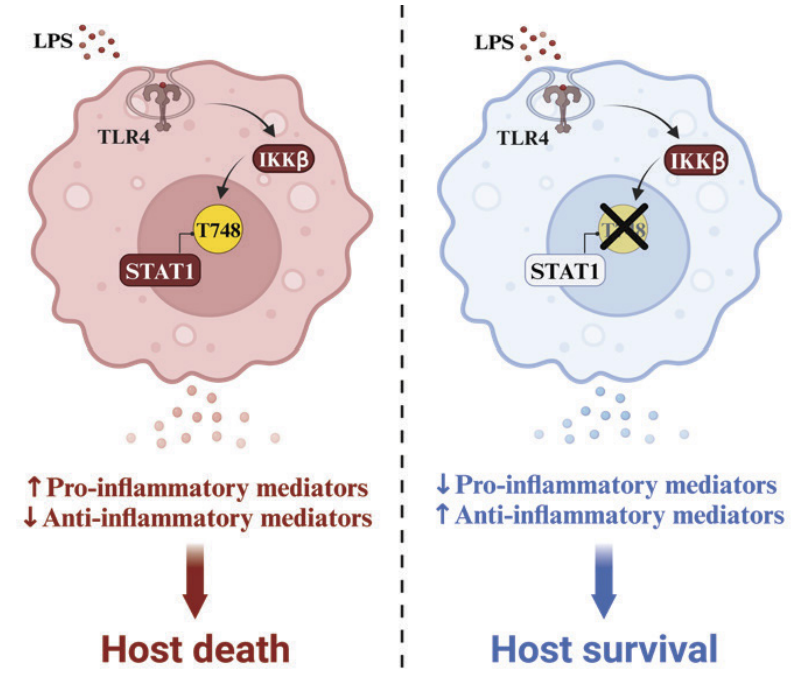
机制总结图
图片来源:https://doi.org/10.1073/pnas.2402226121
总之,本研究为STAT1如何在干扰素-JAK教条之外发挥作用这一长期存在的生物学难题提供了一个可信的解释。研究者的发现表明,STAT1在先天性免疫反应中表现出一种磷酸化依赖的模块化功能:干扰素磷酸化酪氨酸依赖和炎症性磷酸化苏氨酸依赖,这为深入了解STAT1在塑造细胞特异性和上下文依赖反应中的组合信号逻辑提供了更深层次的了解。
此外,本研究激发了未来对其他STAT蛋白TAD中其他可能的功能性苏氨酸磷酸化位点的探索,这可能为深入了解其他STAT蛋白在典型JAK信号传导之外的功能提供更深入的了解。更好地了解STAT1的Thr748磷酸化可能为开发更好、更特异的治疗各种炎症性疾病(如脓毒症)的方法提供机会,而不存在与靶向JAK信号或总STAT1蛋白相关的不良反应的风险。( 100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















