《科学·进展》:陆军军医大学团队发现,移植年轻骨髓可恢复免疫系统活力,并减轻阿尔茨海默病样病理变化 |
 |
《科学·进展》:陆军军医大学团队发现,移植年轻骨髓可恢复免疫系统活力,并减轻阿尔茨海默病样病理变化
来源:奇点糕 2024-06-03 14:50
本项研究不仅揭示机体外周的免疫细胞衰老参与疾病的发生,也为从骨髓免疫细胞起源角度探索疾病的治疗提供了新思路。陆军军医大学大坪医院神经内科的研究团队在著名期刊《科学 进展》上发表一项重要研究成果,他们发现给衰老的小鼠模型移植年轻小鼠的造血,可以减轻老龄小鼠的阿尔茨海默病样病理和行为障碍[1]。
这一发现意味着,通过骨髓移植恢复系统的活力,有望成为治疗阿尔茨海默病的潜在方法。

论文首页截图
在分析阿尔茨海默病相关风险基因之后,研究团队发现,大约一半的基因编码的蛋白参与免疫过程[2,3],这也为免疫与阿尔茨海默病之间存在联系提供了证据。
近年来,还有一些研究发现,脑内或外周的免疫细胞功能失调参与了阿尔茨海默病的病理过程[4,5]。例如,去年9月份,我们就介绍过美国圣裘德儿童研究医院的一项研究,CD8阳性T细胞可以限制阿尔茨海默病的进展[6]。
遗憾的是,随着年龄的增长,免疫系统也会日渐衰老。衰老的免疫系统会表现出新免疫细胞生成减少、免疫细胞的多样性降低,以及功能失调的免疫细胞增多等特点。免疫衰老是人体系统性衰老的重要一环,与等衰老相关疾病的患病风险增加密不可分。
以上研究结果意味着,使衰老的免疫系统年轻化,可能是治疗阿尔茨海默病的潜在策略。由于外周免疫细胞主要来自于,而且其功能也会随着衰老退化;因此该研究团队提出了一个假设,移植年轻的造血干细胞可能会使衰老的免疫恢复活力,最终达到干预阿尔茨海默病的目的。
在研究一开始,研究人员构建了两个骨髓移植小鼠模型:一组将2月龄的年轻APP/PS1小鼠的骨髓(YTg BMCs)移植给9月龄的老龄APP/PS1小鼠;另一组将9月龄的老龄APP/PS1小鼠的骨髓(OTg BMCs)移植给9月龄的老龄APP/PS1小鼠,作为对照。
研究人员注意到,B细胞和CD8阳性T细胞的比例在小鼠衰老过程中和移植年轻小鼠的骨髓后保持稳定;CD4阳性T细胞和NK细胞的比例在小鼠的衰老过程中显著下降,而且在移植年轻小鼠的骨髓后也后没有恢复到年轻时的水平。值得注意的是,在小鼠衰老过程中,单核细胞比例显著增加,但是移植年轻小鼠的骨髓可以让老龄小鼠的单核细胞比例恢复到年轻时的水平。
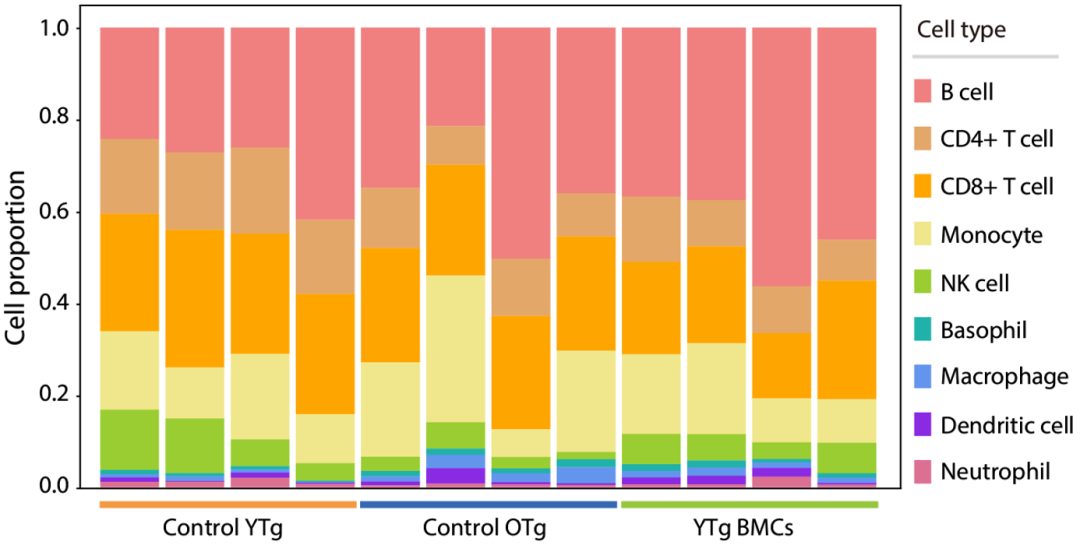
骨髓移植对老龄小鼠外周免疫细胞组成的影响
随后,研究人员从转录组水平分析年轻小鼠和老龄小鼠外周血单个核细胞(PBMCs)的差异。
他们发现,与年轻小鼠相比,老龄小鼠的PBMCs中共有269个基因表达上调,151个基因表达下调。这些差异表达基因被统称为衰老相关差异表达基因(衰老DEGs)。值得注意的是,其中约有三分之一的衰老DEGs在移植年轻小鼠骨髓之后表达模式被逆转,他们将这些基因命名为 逆转DEGs 。
在分析完上述转录组变化之后,他们发现主要血液免疫细胞的基因表达会随着年龄的增长而发生变化,其中最显著的变化发生在单核细胞中,而移植年轻小鼠的骨髓可以缓解这些变化。
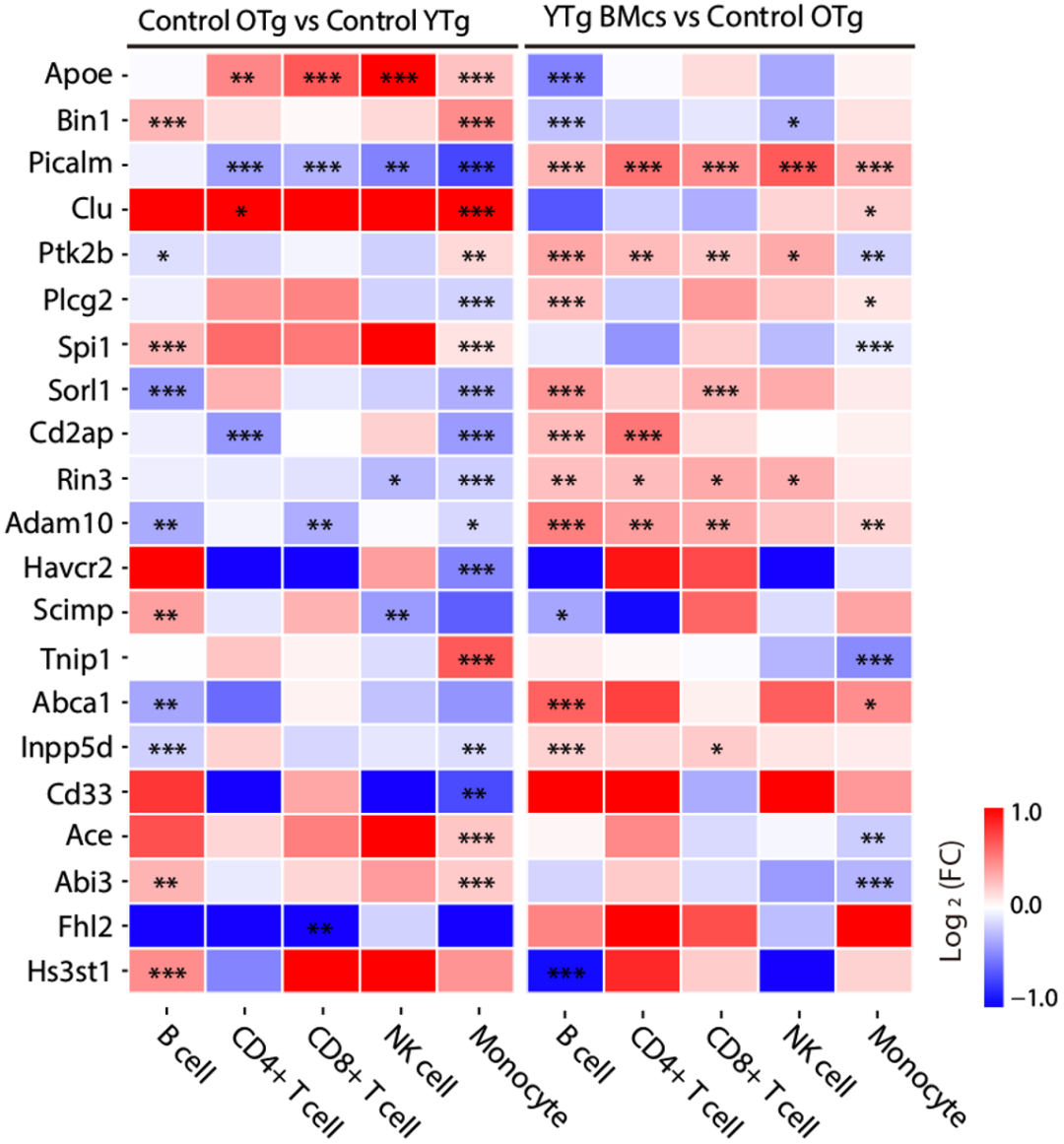
骨髓移植对阿尔茨海默病风险基因表达模式的影响
不仅如此,他们还注意到,移植年轻小鼠的骨髓还可以缓解单核细胞、CD8/4阳性T细胞、B细胞和NK细胞的大多数衰老途径;以及降低血浆中衰老相关蛋白(例如Lgals3bp、Vim和Mmp2等)的水平。
基于以上研究结果不难发现,衰老的外周免疫细胞可能参与了阿尔茨海默病的发病,而单核细胞在其中发挥着着重要作用。好消息是,移植年轻小鼠的骨髓可以逆转免疫细胞的衰老表型。接下来的问题,这些免疫细胞的功能有没有恢复呢,又是否能延缓阿尔茨海默病的进展呢?
该研究团队注意到,虽然随着年龄的增长,单核细胞中Tlr2、Cd33、Syk和Msr1等重要的A 摄取受体的基因表达在下降,但移植年轻小鼠的骨髓可逆转这种下降。体外实验也表明,移植年轻小鼠的骨髓,恢复了衰老单核细胞受损的A 吞噬能力。
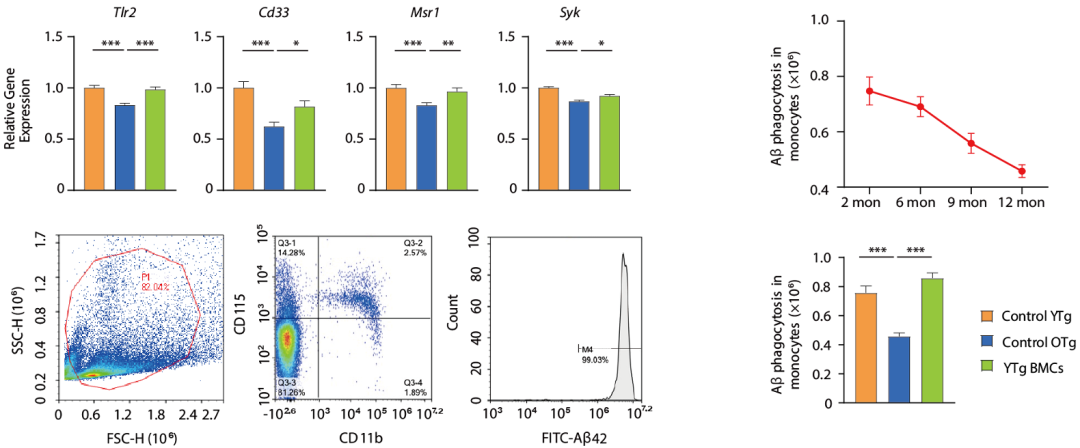
衰老和移植年轻骨髓对单核细胞的影响
在研究的最后,研究团队探索了移植年轻小鼠骨髓对阿尔茨海默病病理,以及小鼠认知的影响。
他们发现,老龄阿尔茨海默病模式小鼠在移植年轻小鼠的骨髓之后,新皮质和海马中的淀粉样斑块显著减少;大脑和血浆中的A 40和A 42水平也显著降低。这说明,移植年轻小鼠的骨髓可以抑制阿尔茨海默病的病理进展。
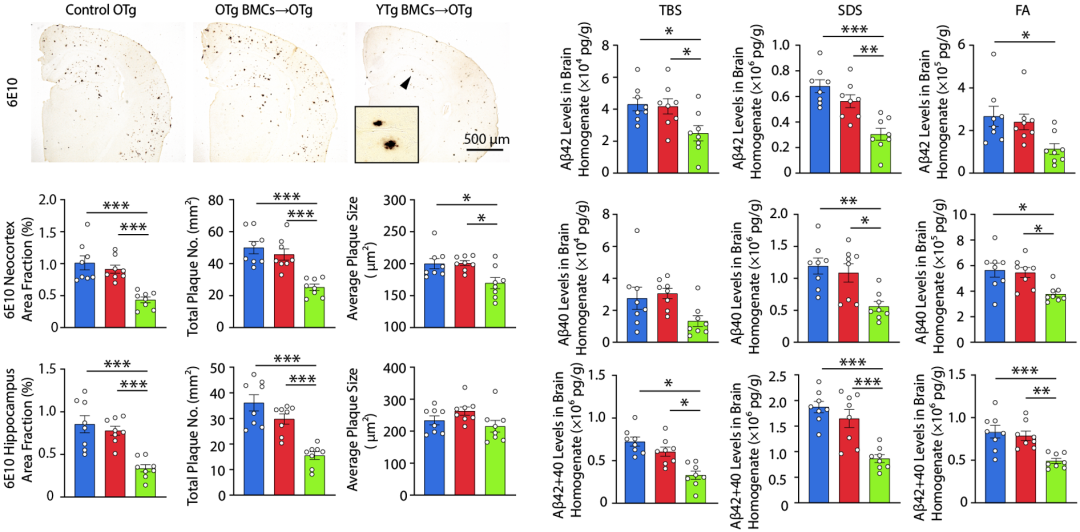
移植年轻小鼠的骨髓可以抑制阿尔茨海默病的病理
此外,与对照组相比,移植年轻小鼠的骨髓还可以降低小胶质细胞活化水平,降低TNF- 和IFN- 等促炎细胞因子的水平,以及降低神经元凋亡和变性的水平,还缓解了海马和新皮质萎缩、侧脑室扩大的程度。
最重要的是,在移植完成三个月之后,研究人员测试了小鼠的认知行为。他们发现,移植年轻小鼠的骨髓能有效改善老年APP/PS1小鼠的认知障碍。
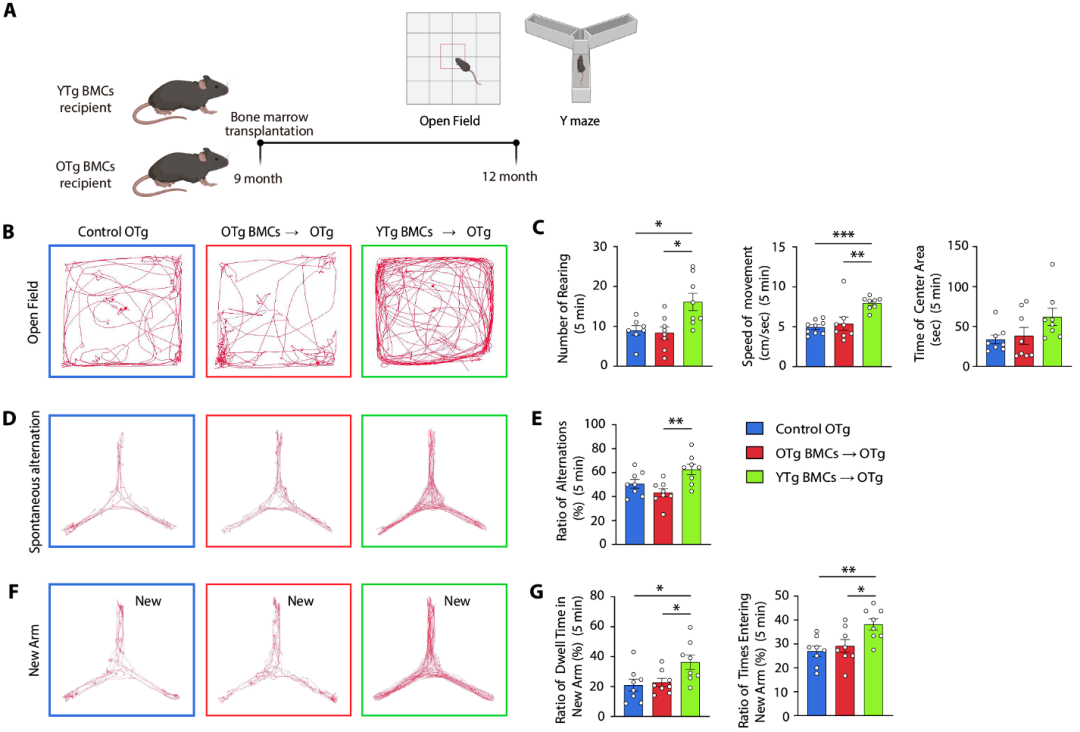
移植年轻小鼠的骨髓能有效改善老龄APP/PS1小鼠的认知
总的来说,大坪医院研究团队的这项研究再次表明免疫衰老在阿尔茨海默病的病理机制中发挥着重要作用,更重要的是,他们基于阿尔茨海默病小鼠模型,证明了骨髓移植带来的免疫年轻化,可以减轻阿尔茨海默病相关病理负担,以及缓解小鼠的认知障碍问题。
该团队过去探讨和提出阿尔茨海默病的系统性发生机制[7],本项研究不仅揭示机体外周的免疫细胞衰老参与疾病的发生,也为从骨髓免疫细胞起源角度探索疾病的治疗提供了新思路。
因此,靶向衰老的免疫细胞,使免疫细胞年轻化,或许是治疗阿尔茨海默病的潜在策略。未来,探索其他更便捷的免疫细胞年轻化策略,或许会加快这项研究成果的临床转化。
参考文献:
[1].Sun PY, Liu J, Hu JN, et al. Rejuvenation of peripheral immune cells attenuates Alzheimer s disease-like pathologies and behavioral deficits in a mouse model. Sci Adv. 2024;10(22):eadl1123. doi:10.1126/sciadv.adl1123
[2].Sims R, Hill M, Williams J. The multiplex model of the genetics of Alzheimer s disease. Nat Neurosci. 2020;23(3):311-322. doi:10.1038/s41593-020-0599-5
[3].Bellenguez C, K kali F, Jansen IE, et al. New insights into the genetic etiology of Alzheimer s disease and related dementias. Nat Genet. 2022;54(4):412-436. doi:10.1038/s41588-022-01024-z
[4].Cao W, Zheng H. Peripheral immune system in aging and Alzheimer s disease [published correction appears in Mol Neurodegener. 2018 Oct 24;13(1):58]. Mol Neurodegener. 2018;13(1):51. Published 2018 Oct 3. doi:10.1186/s13024-018-0284-2
[5].Xu H, Jia J. Single-Cell RNA Sequencing of Peripheral Blood Reveals Immune Cell Signatures in Alzheimer s Disease. Front Immunol. 2021;12:645666. Published 2021 Aug 9. doi:10.3389/fimmu.2021.645666
[6].Su W, Saravia J, Risch I, et al. CXCR6 orchestrates brain CD8+ T cell residency and limits mouse Alzheimer s disease pathology. Nat Immunol. 2023;24(10):1735-1747. doi:10.1038/s41590-023-01604-z
[7].Wang J, Gu BJ, Masters CL, Wang YJ. A systemic view of Alzheimer disease - insights from amyloid- metabolism beyond the brain. Nat Rev Neurol. 2017;13(10):612-623. doi: 10.1038/nrneurol.2017.111.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















