Science:新研究揭示Ctf18 |
 |
来源:100医药网 2024-08-04 11:58
为什么真核细胞进化出了专门用于装载 PCNA 的 Ctf18-RFC,以促进 Polε 合成前导链?DNA聚合酶(Pol),如前导链Pol(Polε)和滞后链Pol(Pol ),在全酶背景下与增殖细胞核抗原(PCNA)DNA滑动夹一起发挥活性和加工能力。PCNA夹是一个封闭的环,需要通过使用ATP的夹装载因子在DNA周围打开和关闭。一般认为,前导链和滞后链 DNA 上的 PCNA 都是由复制因子 C(RFC)装载的,其中RFC 是由 Rfc1 至 Rfc5 组成的五聚体 ATP 酶复合物。不过,近期的研究表明,另一种夹装载因子 Ctf18-RFC 可能负责将 PCNA 加载到前导链上。Ctf18-RFC 与 RFC共享四个亚基(Rfc2 至 Rfc5),但用 Ctf18 取代了 Rfc1,并包括另外两个亚基:Ctf8 和 Dcc1。前导链为什么需要不同的夹装载因子一直是个谜。
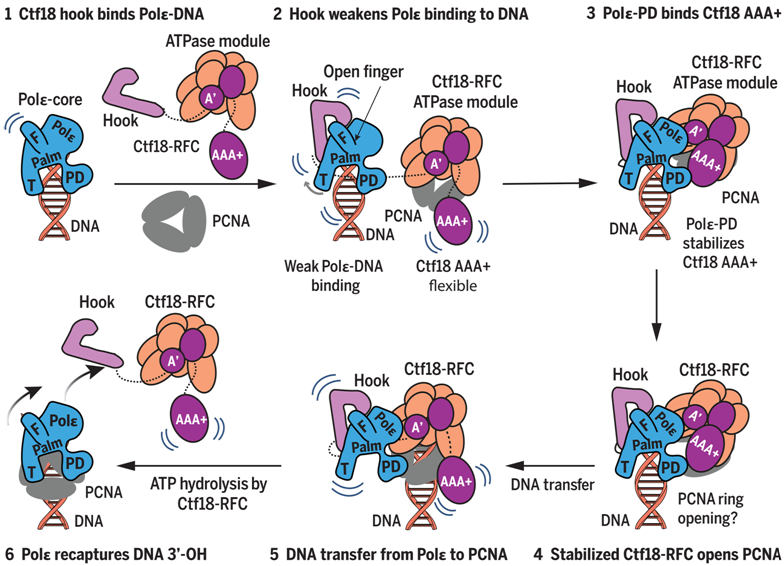
在一项新的研究中,来自洛克菲勒大学和文安德研究所的研究人员试图了解为什么在芽殖的酿酒酵母中,前导链 PCNA 要由 Ctf18-RFC装载。由于 Pol 是在 PCNA装载后被 PCNA 募集到 DNA 上的,而 Polε 则是在复制起点激活过程中作为复制螺旋酶组装过程的一部分被募集到 DNA 上的(在 PCNA装载之前),因此他们假设在 S 期期间,引物的 3 端暴露在滞后链上,可被 RFC 使用,但在前导链上,引物的 3 端可能因距离较近而已被前导链上的 Polε 结合,因此需要专用的前导链夹装载因子。
基于此,他们将纯化的蛋白成分 Ctf18-RFC、PCNA 和 Polε 的催化核心(Polε-core)与模板-引物 DNA 底物在 ATP S 和脱氧核苷酸三磷酸酯(dNTPs)存在或不存在的条件下进行体外混合,然后通过低温电镜(cryo-EM)和相关的二维、三维分类及三维重建探究了由此产生的反应产物。

相关研究结果发表在2024年8月2日的Science期刊上,论文标题为 Mechanism of PCNA loading by Ctf18-RFC for leading-strand DNA synthesis 。
研究者通过低温电镜和生化实验发现,Ctf18-RFC 不需要 Polε 的帮助,也能将 PCNA装载到引物 3 端的 DNA 底物上。意想不到的是,低温电镜结构显示Ctf18 亚基的AAA+结构域具有内在的移动性,这与所有其他夹装载因子都不同。由于这个最大亚基的 AAA+结构域通常为PCNA提供最大的结合表面以打开PCNA夹,因此 Ctf18 AAA+结构域的可移动性可能是其装载 PCNA 效率低的原因。这一特征可能是为了防止 Ctf18-RFC 与 RFC 竞争,将 PCNA装载到引物 3 端容易接触到的滞后链上。
其次,Ctf18-RFC 的装载活性是通过与 Polε 结合来促进的,这表明其特异性是针对前导链进化而来的。第三,Ctf18-RFC 的 Ctf8 和 Dcc1 成分以及 Ctf18羧基端肽形成了钩状结构,可与 Polε 结合并降低 Polε催化结构域与 DNA 结合的亲和力。这可能是将 DNA 从 Polε横向转移到 Ctf18-RFC-PCNA 的先决条件,也可能解释为什么 Ctf18-RFC 进化出了这种特异的钩状结构,以应对 Polε 屏蔽引物 3 端的情况。
第四,在Polε存在的情况下,研究者捕获了两种装载中间产物:一种是DNA在转移到Ctf18-RFC-PCNA之前位于Polε内,另一种是DNA离开Polε并转移到Ctf18-RFC-PCNA。这两种中间产物揭示了 Polε 中的一些特征,比如 P-结构域和氨基端长螺旋能特异性地稳定原本灵活的 Ctf18 AAA+结构域,从而加速 Ctf18-RFC 的装载活性。最后,移除 Polε 和 Ctf18 中这些相互作用的结构元件,就会取消 Polε 对 Ctf18-RFC装载活性的刺激。
通过Ctf18-RFC将Polε依赖性的PCNA装载到前导链DNA上的模型
图片来自Science, 2024, doi:10.1126/science.adk5901
通过解析出一系列与 PCNA、DNA 和Polε-core结合的 Ctf18-RFC 的低温电镜结构,研究者揭示了 Ctf18-RFC 和 Polε 都进化出了相互作用的特殊功能,从而将引物的3 端从 Polε 转移到 Ctf18-RFC,使 PCNA装载到前导链上。这一观察结果解释了为什么真核细胞进化出了专门用于装载 PCNA 的 Ctf18-RFC,以促进 Polε 合成前导链。(100yiyao.com)
参考资料:
Zuanning Yuan et al. . Science, 2024, doi:10.1126/science.adk5901.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 2025年7月Cell期刊精华 (2025-07-29)
- Cell:告别“单兵作战”!SPIDR技术开启“联合作战”新纪元,一次实验看清数十种RNA调控蛋白的“社交网络” (2025-07-29)
- Nature:中国学者开发基因编辑蚊子,有望终结疟疾传播 (2025-07-29)
- Science:利用人工智能揭示蛋白质稳定性规则,有望推进蛋白质工程变革 (2025-07-29)
- 屡获殊荣:诺华川西南林业碳汇项目荣获《南方周末》2025年度ESG创新案例奖 (2025-07-28)
- 一滴血测早期食管癌!Adv Sci:新型生物芯片结合AI,9种囊泡蛋白助诊断准确率超90% (2025-07-28)
- Science:利用新开发的谱系追踪工具绘制肿瘤细胞的历史和位置,从而揭示其生长模式 (2025-07-28)
- Cell:新研究确定了世界上首个有望预防危及生命的HTLV-1病毒感染的新方法 (2025-07-28)
- 华人学者本周发表6篇Cell论文:逆转阿尔茨海默病、软骨再生、先导编辑疗法、卒中后大脑炎症、人类蛋白质组衰老图谱 (2025-07-28)
- Nature子刊:曾木圣/张华/孙聪团队发现首个EB病毒感染上皮细胞的主要受体 (2025-07-28)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















