Science丨通过捕获新冠病毒刺突蛋白中间态,揭示广谱抗冠状病毒机制 |
 |

模式图(Credit: Science)
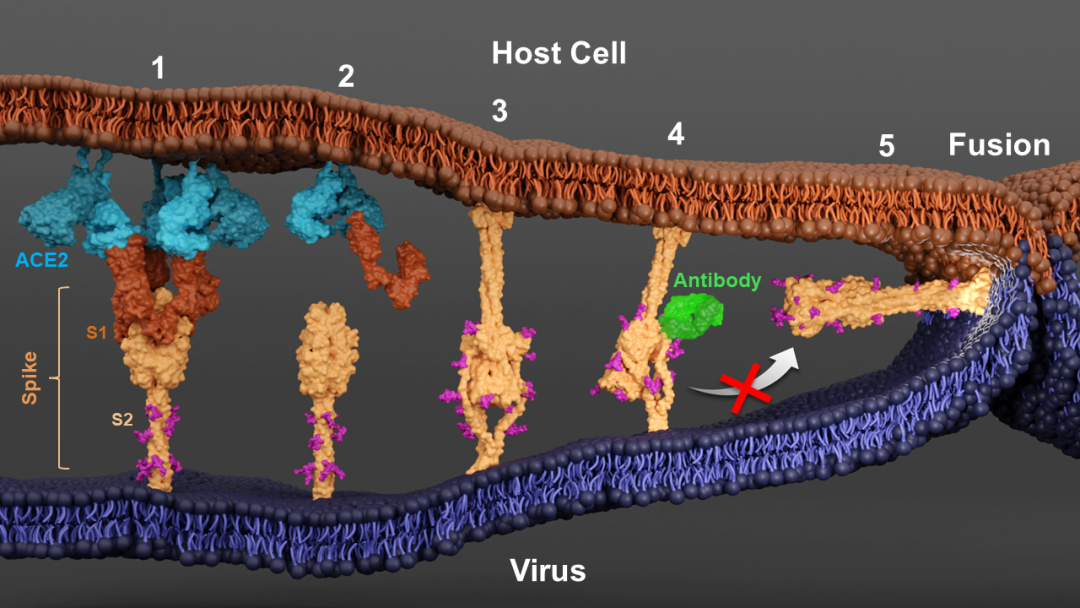
在融合前状态下(prefusion),刺突蛋白三聚体和ACE2受体二聚体相互交联,在膜间形成蛋白阵列,有助于病毒附着于宿主表面。刺突蛋白的三个单体可分别各结合1个ACE2受体二聚体,而受于结构构象的限制,绑定的二聚体ACE2蛋白无法同时结合来自于同一刺突蛋白三聚体的两个单体,但可以与来自相邻的刺突蛋白三聚体的单体结合,进而实现刺突蛋白的交联。这种交联机制在一定程度上增强了spike-ACE2结合的灵活性,为病毒在刺突蛋白上引入突变位点提供了适应性空间。
在热激活后, spike-ACE2复合体会发生构象变化,在病毒膜与宿主膜之间形成杆状结构。该杆状结构与之前发现的融合后状态(post-fusion)的刺突蛋白相似,但是其方向却完全相反 杆状结构从宿主膜延伸,而融合后状态的刺突蛋白则由病毒膜伸出。研究人员推测该杆状结构应该就是之前一直寻找的刺突蛋白的中间态(pre-hairpin intermediate),此时,底端蛋白S2已经将融合肽段插入宿主膜,形成螺旋杆状结构,S2的底部区域则表现出高度可变性,无法通过局部断层平均技术(subtomogram averaging)获得稳定结构。通过局部断层分类(subtomogram classification),研究团队获得到了在病毒膜上具有不同倾斜角度的刺突蛋白中间态,这些倾斜角度与膜间距离呈高度负相关,支持了刺突蛋白通过自身折叠的构象变化拉近病毒膜与宿主膜,最终促使双膜融合的研究模型。
在之前的研究中,研究团队分离出了一类中和抗体可以结合刺突蛋白底部的stem-helix区域【2】,由于该区域在冠状病毒间高度保守,这类抗体可对多种冠状病毒具有中和活性,为泛冠状病毒疫苗的设计提供了理论基础。然而,该类中和抗体的抗病毒机制尚未明了。在本研究中,研究团队证实了此类中和抗体能够结合到刺突蛋白底部的stem-helix区域,且在刺突蛋白发生构象变化后,仍能结合其中间态,但是病毒与宿主膜间距离不能进一步缩小,揭示其阻断了底端蛋白S2的自身折叠。
来自Northeastern University的Paul Whitford和Rice University的Jose Onuchic团队通过分子动力学模拟再现了刺突蛋白从融合前状态,到结合ACE2受体,激活S2构象变化形成中间态,最后自身折叠至融合后状态的过程。引入结合stem-helix区域的中和抗体后,抗体的结合会最终阻断底端蛋白S2的自身折叠。这些模拟结果与本研究中获得的cryo-ET结构高度契合。
刺突蛋白的中间态结构表现出高度动态特性,尤其是stem-helix区域。因此,如何设计原来刺激免疫系统产生针对这一保守区域的中和抗体,将成为开发泛冠状病毒疫苗的重要突破口。
值得注意的是,来自Walther Mothes团队的李文炜,秦专博士去年通过冷冻电镜断层成像技术研究毒入侵过程,也捕捉到了一些此前研究中未能观察到的结构【3】。病毒蛋白在原位膜上与受体结合,以及其后的构象变化远比之前的研究模型复杂。冷冻电镜断层成像技术为原位观察病毒膜蛋白活动提供了新的可能性,弥补了此前仅针对蛋白外膜部分的结构研究的不足。
医药网新闻
- 相关报道
-
- 【参会指南】9月26-27日,2025(第九届)细胞外囊泡前沿与转化大会(厦门站)即将开幕! (2025-09-18)
- 西湖大学最新Cell子刊论文:利用孕妇肠道菌群预测早产风险 (2025-09-17)
- Cell:高分子量tau蛋白抑制海马体神经元活动,导致阿尔茨海默病的认知衰退 (2025-09-17)
- 两篇《自然》:肺癌私联神经元!科学家首次发现小细胞肺癌细胞会在脑内与神经元形成突触,借助电信号促进肿瘤生长 (2025-09-16)
- Sci Adv:新型双特异性抗体有望成为抗击巨细胞病毒的“免疫特种兵” (2025-09-16)
- 《神经病学》:代糖或伤认知!8年随访发现,摄入较多代糖与记忆力、语言流畅性和整体认知能力下降速度提升32%、173%和62%相关 (2025-09-16)
- Nature子刊:超越ADC,中国博后发明ABC药物,重拳出击,精准靶向 (2025-09-16)
- Cell子刊:“滴血验癌”新突破,王延博/张硕等利用细胞外囊泡,精准检测10多种癌症 (2025-09-16)
- 47亿!派林生物易主中国生物,血液制品行业格局将重塑 (2025-09-15)
- 【9月16日直播预告】从样本到洞察:蛋白质组学智能实验室的自动化流程与AI高效赋能 (2025-09-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















